硫化バリウム
硫化バリウム(Barium sulfide)は、BaSの化学式を持つ無機化合物である。硫化バリウムは、炭酸バリウムやリトポン等を含む他のバリウム化合物の重要な前駆体である[2]。他のアルカリ土類金属のカルコゲン化合物と同様に、硫化バリウムは電子ディスプレイで短い波長の光を放出する[3]。無色であるが、他の硫化物と同様に不純なものは着色している。
| 硫化バリウム | |
|---|---|
| |
| 識別情報 | |
| CAS登録番号 | 21109-95-5 |
| PubChem | 6857597 |
| ChemSpider | 5256933 |
| EC番号 | 244-214-4 |
| ChEBI | |
| |
| |
| 特性 | |
| 化学式 | BaS |
| モル質量 | 169.39 g/mol |
| 密度 | 4.25 g/cm3 [1] |
| 融点 |
1200 °C |
| 沸点 |
分解 |
| 水への溶解度 | 2.88 g/100 mL (0 °C) 7.68 g/100 mL (20 °C) 60.3 g/100 mL (100 °C) |
| 溶解度 | アルコールに不溶 |
| 屈折率 (nD) | 2.155 |
| 構造 | |
| 結晶構造 | 岩塩 (六面体), cF8 |
| 空間群 | Fm3m, No. 225 |
| 配位構造 | 八面体 (Ba2+); 八面体 (S2–) |
| 危険性 | |
| EU分類 | 有害 (Xn) 環境に対して危険 (N) |
| EU Index | 016-002-00-X |
| NFPA 704 | |
| Rフレーズ | R20/22, R31, R50 |
| Sフレーズ | (S2), S28, S61 |
| 関連する物質 | |
| その他の陰イオン | 酸化バリウム |
| その他の陽イオン | 硫化マグネシウム 硫化カルシウム 硫化ストロンチウム |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
発見、製造、性質
編集
硫化バリウムは、Vincentius Casciarolus︵1571年-1624年︶によって硫酸バリウム︵重晶石︶の還元により生成された[4]。現在ではCasciarolusの方法を改良して、蛍石の代わりに石炭が用いられている。この反応は、炭素熱還元と呼ばれる。
 この物質は燐光を発することから興味が持たれ、Lapis Boloniensis、Chrysolapis、bologna stone等として知られた[5][6][7]。様々な錬金術師や化学者がこの物質で実験を行った。
アンドレアス・マルクグラーフは、方解石や石膏はbologna stoneを生成するのには適さないが、特殊な重い蛍石を用いることができることを示し、最終的に硫酸カルシウムからbologna stoneが生成できると結論付けた[8]。
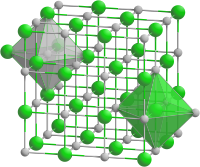
硫化バリウムの結晶は塩化ナトリウム型で、Ba2+とS2-を中心に持つ八面体構造である。
この物質は燐光を発することから興味が持たれ、Lapis Boloniensis、Chrysolapis、bologna stone等として知られた[5][6][7]。様々な錬金術師や化学者がこの物質で実験を行った。
アンドレアス・マルクグラーフは、方解石や石膏はbologna stoneを生成するのには適さないが、特殊な重い蛍石を用いることができることを示し、最終的に硫酸カルシウムからbologna stoneが生成できると結論付けた[8]。
硫化バリウムの結晶は塩化ナトリウム型で、Ba2+とS2-を中心に持つ八面体構造である。
 この物質は燐光を発することから興味が持たれ、Lapis Boloniensis、Chrysolapis、bologna stone等として知られた[5][6][7]。様々な錬金術師や化学者がこの物質で実験を行った。
アンドレアス・マルクグラーフは、方解石や石膏はbologna stoneを生成するのには適さないが、特殊な重い蛍石を用いることができることを示し、最終的に硫酸カルシウムからbologna stoneが生成できると結論付けた[8]。
硫化バリウムの結晶は塩化ナトリウム型で、Ba2+とS2-を中心に持つ八面体構造である。
この物質は燐光を発することから興味が持たれ、Lapis Boloniensis、Chrysolapis、bologna stone等として知られた[5][6][7]。様々な錬金術師や化学者がこの物質で実験を行った。
アンドレアス・マルクグラーフは、方解石や石膏はbologna stoneを生成するのには適さないが、特殊な重い蛍石を用いることができることを示し、最終的に硫酸カルシウムからbologna stoneが生成できると結論付けた[8]。
硫化バリウムの結晶は塩化ナトリウム型で、Ba2+とS2-を中心に持つ八面体構造である。
安全性
編集出典
編集- ^ Lide, David R., ed. (2006). CRC Handbook of Chemistry and Physics (87th ed.). Boca Raton, FL: CRC Press. ISBN 0-8493-0487-3.
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Vij, D. R.; Singh, N. "Optical and electrical properties of II-VI wide gap semiconducting barium sulfide" Proceedings of SPIE (1992), 1523 (Conf. Phys. Technol. Semicond. Devices Integr. Circuits, 1992), 608-12.
- ^ F. Licetus, Litheosphorus, sive de lapide Bononiensi lucem in se conceptam ab ambiente claro mox in tenebris mire conservante, Utini, ex typ. N. Schiratti, 1640. See http://www.chem.leeds.ac.uk/delights/texts/Demonstration_21.htm
- ^ “Lapis Boloniensis”. www.zeno.org. 2012年12月27日閲覧。
- ^ Lemery, Nicolas (1714). Trait℗e universel des drogues simples
- ^ Ozanam, Jacques; Montucla, Jean Etienne; Hutton, Charles (1814). Recreations in mathematics and natural philosophy ..
- ^ Marggraf, Andreas Sigismund (1767). Chymische Schriften
