ジアゾニウム化合物
(ジアゾ化から転送)
ジアゾニウム化合物︵ジアゾニウムかごうぶつ、diazonium compound︶は分子内に置換基 −N+≡N を含む有機窒素化合物である。一価のモノカチオン性置換基 −N+≡N をジアゾニオ基 (diazonio)、R−N+≡N と表されるカチオンをジアゾニウムイオン (diazonium ion)、ジアゾニウムイオンを含む塩のことをジアゾニウム塩と呼ぶ。

ジアゾニウム塩の一般構造式
ジアゾ化︵ジアゾか、diazotization︶とは、一級アミンに亜硝酸 (HNO2) または亜硝酸エステル (RONO) などを作用させ、対応するジアゾニウム化合物を得る反応である。広義には、ジアゾニウム化合物を経由する各種合成反応も含む。
 一般にジアゾニウム塩は反応活性が高く、反応中間体としてさまざまな用途に用いられる。
一般にジアゾニウム塩は反応活性が高く、反応中間体としてさまざまな用途に用いられる。

 一般にジアゾニウム塩は反応活性が高く、反応中間体としてさまざまな用途に用いられる。
一般にジアゾニウム塩は反応活性が高く、反応中間体としてさまざまな用途に用いられる。
調製と性質
編集
一級アミンを酸性水溶液中で亜硝酸塩︵おもに亜硝酸ナトリウム︶に作用させると、速やかにジアゾニウム塩を生成する。この反応は1858年に J. P. Griess により発見された。Griess反応とも呼ばれるこの反応は、脂肪族アミンでも芳香族アミンでも同様に進行するが、脂肪族アミンの場合は氷冷下でもジアゾニウム塩が速やかに分解する。
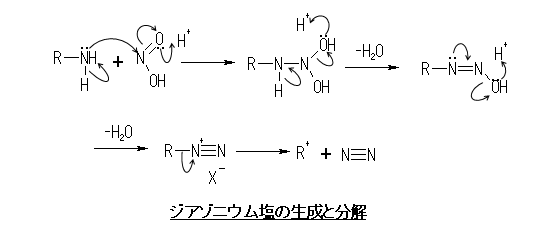
ジアゾニウム塩の生成と分解
亜硝酸による反応の活性種はN2O3 で、アミンと付加してできる中間体 R−N+H2−N=O から脱水してジアゾニウムイオンに変わるものと考えられている[1]。
共鳴効果による安定化の寄与を持つ芳香族ジアゾニウム塩はある程度安定で、カウンターアニオンを適切に選択すれば固体として単離することも可能である。一般には HSO4− <Cl− <NO3− < ClO4− の順に安定であると言われている。しかし、芳香族ジアゾニウム塩であっても乾燥、加熱、日光下ではN2 ガスを放出して分解し、大量の場合は爆発することもある︵図ではイオン機構で分解するように表現したが、ラジカル機構による場合もある︶。テトラフルオロホウ酸塩やヘキサフルオロリン酸塩は比較的安定で単離して取り扱うことができ、後者は市販品が入手可能である。ヘキサクロロ白金(IV)酸アニオンとは塩 [PtCl6](ArN2)2 を形成する。しかし通常はジアゾニウム化合物を保存して用いる手法はとられず、もっぱら上記のジアゾ化反応により系中で発生させる。
芳香環が単純なジアゾニウム塩は水に溶けやすく、アルコールに難溶、エーテルにはほとんど溶けない。芳香族ジアゾニウムイオンは酸性水溶液ではジアゾニウムとして存在するが、水酸化アルカリ MOH とはジアゾタートM+[Ar−N=N−O−] を形成する。芳香族ジアゾタートは2つの異性体を持ち、加温により n-体︵ノルマル体、直鎖状︶から iso-体︵イソ体、枝分かれ構造の一種︶へと変化する。 芳香族ジアゾタートは無機酸により芳香族ジアゾニウム塩へ戻る。
芳香族ジアゾニウムイオンはまた、シアン化カリウムと反応するとジアゾシアニド ArN=NCN を生成し、亜硫酸水素カリウムと反応するとジアゾスルホナート ArN=NSO3−K+を生成する。ジアゾシアニドもジアゾスルホナートも n-体と iso-体との異性体が存在する[2]。
脂肪族のジアゾニウム塩は容易に置換反応や脱離反応を起こすため、単離されることはほとんどない。デミヤノフ転位や、ジアゾメタンによるカルボン酸のメチル化などにおいて、活性の高い反応中間体として現れる。

ジアゾニオ基の性質
編集ジアゾニウム塩の反応
編集
芳香族ジアゾニウム塩は有機溶媒に難溶な場合が多く、もっぱら水溶液中でジアゾ化反応が実施される。その場合不安定なジアゾニウム塩が分解すると速やかに溶媒の水と反応し、元のアミノ基の位置で置換したフェノール化合物が得られる場合が多い。この反応はSN1的であり、他のジアゾニウム塩を用いた反応の副反応となる場合が多い。これを防ぐため、濃硫酸中でジアゾ化を行うことがある。脂肪族ジアゾニウム塩は水に対してきわめて不安定で、SN2的な求核置換反応により直ちにアルコールと窒素に分解する。
 以下に、ジアゾニウム塩を用いる各種合成反応を挙げる[1]。
以下に、ジアゾニウム塩を用いる各種合成反応を挙げる[1]。
 以下に、ジアゾニウム塩を用いる各種合成反応を挙げる[1]。
以下に、ジアゾニウム塩を用いる各種合成反応を挙げる[1]。
ザンドマイヤー反応
編集詳細は「ザンドマイヤー反応」を参照
芳香族ジアゾニウム塩をフッ素を除くハロゲン化銅(I)あるいはシアン化銅(I)、チオシアン化銅(I)の存在下に生成させ、加温分解すると、元のアミノ基の位置が対応するハロゲンあるいはシアノ基・チオシアノ基で置き換えられた置換アリール体が得られる。この反応は1884年に発見した T. Sandmeyer に因んでザンドマイヤー反応と呼ばれる。この反応は一電子移動を含むラジカル的な機構を経て進行し、中間体としてアリール銅化合物を経由すると考えられている。
- (X = Cl, Br, CN, SCN)
ハロゲンがフッ素の場合はフッ化銅(II)がフッ化銅(I)に比べて安定なため反応が進行しない(フッ化銅(I) は放置すると不均化を起こしてフッ化銅(II)と金属銅となる)。
他の芳香族置換反応
編集
ジアゾニウム塩を経由するフッ化アリールの合成法としてシーマン反応が知られている。シーマン反応では、テトロフルオロホウ酸芳香族ジアゾニウム塩を熱分解することで、相当するアミノ基の位置でフッ素が置換したフッ化アリールが得られるが、概して収率はよくない。アリールカチオンが発生するSN1機構を経ると考えられている。
 ハロゲンがヨウ素の場合は、特に触媒を必要とせず、ヨウ化物イオン (I−) のみの作用で置換反応が進行する。
ハロゲンがヨウ素の場合は、特に触媒を必要とせず、ヨウ化物イオン (I−) のみの作用で置換反応が進行する。
 2-アミノピリジンから発生させたジアゾニウム塩は、ハロゲン化水素と反応して 2-ハロピリジンを与える︵Craig 法︶。
さまざまな硫黄求核種 (RS−, SO2 etc.) とも反応し、対応する芳香族硫黄化合物を与える。遷移金属触媒を用いたクロスカップリング反応の基質として用いられる例もある。
2-アミノピリジンから発生させたジアゾニウム塩は、ハロゲン化水素と反応して 2-ハロピリジンを与える︵Craig 法︶。
さまざまな硫黄求核種 (RS−, SO2 etc.) とも反応し、対応する芳香族硫黄化合物を与える。遷移金属触媒を用いたクロスカップリング反応の基質として用いられる例もある。
 ハロゲンがヨウ素の場合は、特に触媒を必要とせず、ヨウ化物イオン (I−) のみの作用で置換反応が進行する。
ハロゲンがヨウ素の場合は、特に触媒を必要とせず、ヨウ化物イオン (I−) のみの作用で置換反応が進行する。
 2-アミノピリジンから発生させたジアゾニウム塩は、ハロゲン化水素と反応して 2-ハロピリジンを与える︵Craig 法︶。
さまざまな硫黄求核種 (RS−, SO2 etc.) とも反応し、対応する芳香族硫黄化合物を与える。遷移金属触媒を用いたクロスカップリング反応の基質として用いられる例もある。
2-アミノピリジンから発生させたジアゾニウム塩は、ハロゲン化水素と反応して 2-ハロピリジンを与える︵Craig 法︶。
さまざまな硫黄求核種 (RS−, SO2 etc.) とも反応し、対応する芳香族硫黄化合物を与える。遷移金属触媒を用いたクロスカップリング反応の基質として用いられる例もある。
ジアゾカップリング
編集
芳香族ジアゾニウム塩は、電子供与性基を持つアミノアリール化合物あるいはフェノール化合物のパラ位に求電子的な攻撃を行い、シグマ錯体を経由する芳香族求電子置換反応により、'N末端とアリールがカップリングしたアゾ化合物︵アゾベンゼンの誘導体︶を与える。この反応はアゾカップリングとも呼ばれる。
 ジアゾ化合物は発色団となる為に、この方法で種々のベンゼンあるいはナフタレン化合物を基質として種々の新規色素︵アゾ色素︶が合成された。電子供与性基を持つアリール化合物は酸性条件化ではプロトン化することで電子供与性が減弱する場合がある。したがって(ジ)アゾカップリングはアミノアリールとの場合は中性~アルカリ性、フェノール化合物との場合はアルカリ性で反応させる必要がある。
ジアゾニウム塩は脂肪族のカルバニオンとも結合を作る。活性メチン化合物と結合して脱炭酸または脱カルボン酸後にヒドラゾンを与える反応が知られており、ヤップ・クリンゲマン反応と呼ばれる。
ジアゾ化合物は発色団となる為に、この方法で種々のベンゼンあるいはナフタレン化合物を基質として種々の新規色素︵アゾ色素︶が合成された。電子供与性基を持つアリール化合物は酸性条件化ではプロトン化することで電子供与性が減弱する場合がある。したがって(ジ)アゾカップリングはアミノアリールとの場合は中性~アルカリ性、フェノール化合物との場合はアルカリ性で反応させる必要がある。
ジアゾニウム塩は脂肪族のカルバニオンとも結合を作る。活性メチン化合物と結合して脱炭酸または脱カルボン酸後にヒドラゾンを与える反応が知られており、ヤップ・クリンゲマン反応と呼ばれる。
 ジアゾ化合物は発色団となる為に、この方法で種々のベンゼンあるいはナフタレン化合物を基質として種々の新規色素︵アゾ色素︶が合成された。電子供与性基を持つアリール化合物は酸性条件化ではプロトン化することで電子供与性が減弱する場合がある。したがって(ジ)アゾカップリングはアミノアリールとの場合は中性~アルカリ性、フェノール化合物との場合はアルカリ性で反応させる必要がある。
ジアゾニウム塩は脂肪族のカルバニオンとも結合を作る。活性メチン化合物と結合して脱炭酸または脱カルボン酸後にヒドラゾンを与える反応が知られており、ヤップ・クリンゲマン反応と呼ばれる。
ジアゾ化合物は発色団となる為に、この方法で種々のベンゼンあるいはナフタレン化合物を基質として種々の新規色素︵アゾ色素︶が合成された。電子供与性基を持つアリール化合物は酸性条件化ではプロトン化することで電子供与性が減弱する場合がある。したがって(ジ)アゾカップリングはアミノアリールとの場合は中性~アルカリ性、フェノール化合物との場合はアルカリ性で反応させる必要がある。
ジアゾニウム塩は脂肪族のカルバニオンとも結合を作る。活性メチン化合物と結合して脱炭酸または脱カルボン酸後にヒドラゾンを与える反応が知られており、ヤップ・クリンゲマン反応と呼ばれる。
ラジカル的カップリング
編集芳香族ジアゾニウム塩を水酸化ナトリウムで処理してアルカリ条件下で分解するとホモリティックな開裂によりアリールラジカルが発生する。これが別の電子豊富な芳香環と反応するとアミノ基があった位置で二量化したビアリール化合物を与える。この反応はゴンバーグ反応、あるいはゴンバーグ・バックマン反応 (Gomberg-Bachmann reaction) と呼ばれる。
アリールラジカルに対し電子求引基を持つアルケンが反応してスチレン誘導体を与える反応をメーヤワインアリール化 (Meerwein arylation) と呼ぶ。銅(II)塩が加えられる。
Dutt-Wormall 反応
編集スルホンアミドを付加させた後に塩基を加えると、アジドが得られる。
ジアゾニウム塩の還元
編集芳香族ジアゾニウム塩は塩化スズ(II)、亜硫酸ナトリウムまたは亜硝酸ナトリウムで還元すると相当するアリールヒドラジン誘導体を与える。