「有機ヒ素化合物」の版間の差分
m →天然 |
|||
| (12人の利用者による、間の12版が非表示) | |||
| 1行目: | 1行目: | ||
'''有機ヒ素化合物'''(Organoarsenic compound)は、[[ヒ素]]と[[炭素]]の間に[[化学結合]]を持つ化合物である。[[殺虫剤]]、[[除草剤]]、[[殺菌剤]]として用いるために産業的に製造されるものもある。一般的にこれらの用途は、環境や人の健康への懸念から徐々に少なくなってきている。元となる化合物は、[[アルシン]]と[[ヒ酸]]である。その毒性にも |
'''有機ヒ素化合物'''(Organoarsenic compound)は、[[ヒ素]]と[[炭素]]の間に[[化学結合]]を持つ化合物である。[[殺虫剤]]、[[除草剤]]、[[殺菌剤]]として用いるために産業的に製造されるものもある。一般的にこれらの用途は、環境や人の健康への懸念から徐々に少なくなってきている。元となる化合物は、[[アルシン]]と[[ヒ酸]]である。その毒性にもかかわらず、有機ヒ素化合物の[[生体物質]]はよく知られている。
|
||
==歴史== |
== 歴史 == |
||
驚くことに現在はマイナーな分野と考えられている有機ヒ素化学は、化学の歴史において重要な役割を果たしてきた。既知の最も古い有機ヒ素化合物であり、不快な臭いを持つ[[カコジル]は、最初の[[有機金属]]とされることもある。[[サルバルサン]]は最初の[[医薬品]]の1つで、[[パウル・エールリヒ]]に[[ノーベル生理学・医学賞]]をもたらした。他のいくつかの有機ヒ素化合物も、かつては[[抗生物質]]や医薬品として用いられていた<ref>Singh, R. Synthetic Drugs. Mittal Publications (2002).ISBN 817099831X</ref>。
|
驚くことに現在はマイナーな分野と考えられている有機ヒ素化学は、化学の歴史において重要な役割を果たしてきた。既知の最も古い有機ヒ素化合物であり、不快な臭いを持つ[[カコジル]]は、最初の[[有機金属]]とされることもある。[[サルバルサン]]は最初の[[医薬品]]の1つで、[[パウル・エールリヒ]]に[[ノーベル生理学・医学賞]]をもたらした。他のいくつかの有機ヒ素化合物も、かつては[[抗生物質]]や医薬品として用いられていた<ref>Singh, R. Synthetic Drugs. Mittal Publications (2002).ISBN 817099831X</ref>。
|
||
==合成と分類== |
== 合成と分類 == |
||
ヒ素は通常、IIIか |
ヒ素は通常、IIIかVの[[酸化数]]を持ち、その化合物はAsX<sub>3</sub> |
||
(X = F, Cl, Br, I)及びAsX<sub>5</sub>と書ける。これに対応して、有機ヒ素化合物もこの2つの酸化数で見られる<ref>Sabina C. Grund, Kunibert Hanusch, Hans Uwe Wolf "Arsenic and Arsenic Compounds" in ''Ullmann's Encyclopedia of Industrial Chemistry'', VCH-Wiley, 2008, Weinheim.</ref>。 |
(X = F, Cl, Br, I)及びAsX<sub>5</sub>と書ける。これに対応して、有機ヒ素化合物もこの2つの酸化数で見られる<ref>Sabina C. Grund, Kunibert Hanusch, Hans Uwe Wolf "Arsenic and Arsenic Compounds" in ''Ullmann's Encyclopedia of Industrial Chemistry'', VCH-Wiley, 2008, Weinheim.</ref>。 |
||
===有機ヒ素化合物(V)=== |
=== 有機ヒ素化合物(V) === |
||
ヒ素(V)化合物は、RAsO(OH)<sub>2</sub>またはR<sub>2</sub>AsO(OH)の官能基を持つことが多い(R = アルキル基またはアリル基)。化学式(CH<sub>3</sub>)<sub>2</sub>AsO<sub>2</sub>Hの[[カコジル酸]]は有機ヒ素化学全体において非常に重要である。これとは対照的に、[[ジメチルホスホン酸]]は、[[有機リン化学]]における重要性は少ない。カコジル酸は、[[三酸化二ヒ素]]をメチル化することで得られる。[[フェニルアルソン酸]](C<sub>6</sub>H<sub>5</sub>AsO(OH)<sub>2</sub>)は、[[ベシャンプ反応]]と呼ばれる[[ヒ酸]]と[[アニリン]]の反応により得られる。
|
ヒ素(V)化合物は、RAsO(OH)<sub>2</sub>またはR<sub>2</sub>AsO(OH)の官能基を持つことが多い(R = アルキル基またはアリル基)。化学式(CH<sub>3</sub>)<sub>2</sub>AsO<sub>2</sub>Hの[[カコジル酸]]は有機ヒ素化学全体において非常に重要である。これとは対照的に、[[ジメチルホスホン酸]]は、[[有機リン化学]]における重要性は少ない。カコジル酸は、[[三酸化二ヒ素]]をメチル化することで得られる。[[フェニルアルソン酸]](C<sub>6</sub>H<sub>5</sub>AsO(OH)<sub>2</sub>)は、[[ベシャンプ反応]]と呼ばれる[[ヒ酸]]と[[アニリン]]の反応により得られる。
|
||
モノメチル酸であるメタンアルソン酸(CH<sub>3</sub>AsO(OH)<sub>2</sub>)は、コメやワタの栽培の殺菌剤である[[ネオアソジン]]の前駆体である。[[ロキサルソン]](4-ヒドロキシ-3-ニトロベンゼンアルソン酸)や[[ウレイドフェニルアルソン酸]]、p-[[アルサニル酸]]等のフェニルアルソン酸誘導体は、家畜の餌の添加物として用いられる。環境中に可溶型のヒ素を排出する怖れがあるため、これらの用途については批判もある。 |
モノメチル酸であるメタンアルソン酸(CH<sub>3</sub>AsO(OH)<sub>2</sub>)は、コメやワタの栽培の殺菌剤である[[ネオアソジン]]の前駆体である。[[ロキサルソン]](4-ヒドロキシ-3-ニトロベンゼンアルソン酸)や[[ウレイドフェニルアルソン酸]]、p-[[アルサニル酸]]等のフェニルアルソン酸誘導体は、家畜の餌の添加物として用いられる。環境中に可溶型のヒ素を排出する怖れがあるため、これらの用途については批判もある。 |
||
ヒ素(V)化合物で有機リガンドのみを持つものは珍しく、ほとんどはペンタフェニル誘導体As(C<sub>6</sub>H<sub>5</sub>)<sub>5</sub>である<ref name=Elsch>Elschenbroich, C. "Organometallics" (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2</ref>。 |
ヒ素(V)化合物で有機リガンドのみを持つものは珍しく、ほとんどはペンタフェニル誘導体As(C<sub>6</sub>H<sub>5</sub>)<sub>5</sub>である<ref name="Elsch">Elschenbroich, C. "Organometallics" (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2</ref>。 |
||
===有機ヒ素化合物(III)=== |
=== 有機ヒ素化合物(III) === |
||
このカテゴリの大分部の化合物は、[[三塩化ヒ素]](AsCl<sub>3</sub>)及びその誘導体から有機[[リチウム]]または[[グリニャール試薬]]を用いた[[アルキル化]]によって生成される<ref name=Elsch/>。例えば、[[トリメチルアルシン]]((CH<sub>3</sub>)<sub>3</sub>As)、[[塩化ジメチルアルシン]]((CH<sub>3</sub>)<sub>2</sub>AsCl)、[[二塩化メチルアルシン]](CH<sub>3</sub>AsCl<sub>2</sub>)の一連の化合物が知られている。水素化還元剤による塩化物誘導体の還元により、[[ジメチルアルシン]]((CH<sub>3</sub>)<sub>2</sub>AsH)、[[メチルアルシン]](CH<sub>3</sub>AsH<sub>2</sub>)等の対応する水素化物が得られる。同様の操作は、他の塩化有機ヒ素化合物に対しても可能である。 |
このカテゴリの大分部の化合物は、[[三塩化ヒ素]](AsCl<sub>3</sub>)及びその誘導体から有機[[リチウム]]または[[グリニャール試薬]]を用いた[[アルキル化]]によって生成される<ref name=Elsch/>。例えば、[[トリメチルアルシン]]((CH<sub>3</sub>)<sub>3</sub>As)、[[塩化ジメチルアルシン]]((CH<sub>3</sub>)<sub>2</sub>AsCl)、[[二塩化メチルアルシン]](CH<sub>3</sub>AsCl<sub>2</sub>)の一連の化合物が知られている。水素化還元剤による塩化物誘導体の還元により、[[ジメチルアルシン]]((CH<sub>3</sub>)<sub>2</sub>AsH)、[[メチルアルシン]](CH<sub>3</sub>AsH<sub>2</sub>)等の対応する水素化物が得られる。同様の操作は、他の塩化有機ヒ素化合物に対しても可能である。 |
||
ジメチルアルシン化合物製造の重要なルートは、カコジル酸の還元から始まる。 |
ジメチルアルシン化合物製造の重要なルートは、カコジル酸の還元から始まる。 |
||
: <chem>(CH3)2AsO2H\ + 2Zn\ +4 HCl -> (CH3)2AsH\ + 2ZnCl2\ + 2H2O</chem> |
|||
:(CH<sub>3</sub>)<sub>2</sub>AsO<sub>2</sub>H + 2 Zn + 4 HCl → (CH<sub>3</sub>)<sub>2</sub>AsH + 2 ZnCl<sub>2</sub> + 2 H<sub>2</sub>O |
|||
: <chem>(CH3)2AsO2H\ + SO2\ + HI -> (CH3)2AsI\ + SO3\ + H2O</chem> |
|||
:(CH<sub>3</sub>)<sub>2</sub>AsO<sub>2</sub>H + SO<sub>2</sub> + HI → (CH<sub>3</sub>)<sub>2</sub>AsI + SO<sub>3</sub> + H<sub>2</sub>O |
|||
ヒ素(III)を含む様々なヘテロ環が知られている。これらには、[[ピロール]]の[[アナログ (化学)|アナログ]]である[[アルソール]]や[[ピリジン]]のアナログである[[アルサベンゼン]]がある。 |
ヒ素(III)を含む様々なヘテロ環が知られている。これらには、[[ピロール]]の[[アナログ (化学)|アナログ]]である[[アルソール]]や[[ピリジン]]のアナログである[[アルサベンゼン]]がある。 |
||
| 26行目: | 26行目: | ||
トリメチルアルシンやトリフェニルアルシン等の対称な有機ヒ素(III)化合物は、配位化学のリガンドとして用いられる。これらは[[ホスフィン]]のリガンドのように振る舞うが、塩基性は弱い。[[ジアルシン]]C<sub>6</sub>H<sub>4</sub>(As(CH<sub>3</sub>)<sub>2</sub>)<sub>2</sub>は、キレートリガンドである。[[トリン]]は、いくつかの金属の指示薬となる。 |
トリメチルアルシンやトリフェニルアルシン等の対称な有機ヒ素(III)化合物は、配位化学のリガンドとして用いられる。これらは[[ホスフィン]]のリガンドのように振る舞うが、塩基性は弱い。[[ジアルシン]]C<sub>6</sub>H<sub>4</sub>(As(CH<sub>3</sub>)<sub>2</sub>)<sub>2</sub>は、キレートリガンドである。[[トリン]]は、いくつかの金属の指示薬となる。 |
||
===有機ヒ素化合物(I)=== |
=== 有機ヒ素化合物(I) === |
||
利用や数が最も少ないのは、有機ヒ素(I)化合物である。抗[[梅毒]]薬の[[サルバルサン]]や[[ネオサルバルサン]]は、この分類の代表である。これらの化合物は、ヒ素原子への結合を3つ持っているが、ヒ素原子同士の結合はほぼ単結合のみである。ヒ素(I)の化合物であるがヒ素原子同士の間に二重結合を持つものはめったにない。 |
利用や数が最も少ないのは、有機ヒ素(I)化合物である。抗[[梅毒]]薬の[[サルバルサン]]や[[ネオサルバルサン]]は、この分類の代表である。これらの化合物は、ヒ素原子への結合を3つ持っているが、ヒ素原子同士の結合はほぼ単結合のみである。ヒ素(I)の化合物であるがヒ素原子同士の間に二重結合を持つものはめったにない。 |
||
==化学兵器== |
== 化学兵器 == |
||
特にAs-Cl結合を持つ有機ヒ素化合物は、特に[[第一次世界大戦]]中に[[化学兵器]]として用いられていた。[[ルイサイト]]や[[ジフェニルクロロアルシン]]、[[フェニルジクロロアルシン]]等がある。 |
特にAs-Cl結合を持つ有機ヒ素化合物は、特に[[第一次世界大戦]]中に[[化学兵器]]として用いられていた。[[ルイサイト]]や[[ジフェニルクロロアルシン]]、[[フェニルジクロロアルシン]]等がある。 |
||
==天然== |
== 天然 == |
||
ヒ素は大 |
ヒ素は大部分の生命にとって有害であり、この濃度が高くなる地域もあるため、様々な解毒法が進化してきた。[[食物連鎖]]に入った無機ヒ素やその化合物は、漸進的に代謝され、メチル化されてより毒性の少ない形態になる<ref>{{cite journal|last=Reimer|first=K. J.|author2=Koch, I. |author3=Cullen, W. R. |year=2010|title=Organoarsenicals. Distribution and transformation in the environment|journal=Metal ions in life sciences|publisher=RSC publishing|location=Cambridge|volume=7 |pages=165-229|isbn=978-1-84755-177-1|doi=10.1039/9781849730822-00165|pmid=20877808}}</ref>。有機ヒ素化合物は、無機ヒ素化合物が生体内で[[ビタミンB12]]関連酵素により<ref>{{cite journal | title = Biomethylation of Arsenic in an Arsenic-rich Freshwater Environment | author = Toshikazu Kaise, Mitsuo Ogura, Takao Nozaki, Kazuhisa Saitoh, Teruaki Sakurai, Chiyo Matsubara, Chuichi Watanabe, Ken'ichi Hanaoka | journal = Applied Organometallic Chemistry | volume = 11 | issue = | pages = 297–304 | year = 1998 | doi = 10.1002/(SICI)1099-0739(199704)11:4<297::AID-AOC584>3.0.CO;2-0| url = }}</ref>メチル化されることにより生成する<ref>{{cite journal|last=Dopp|first=E.|author2=Kligerman, A. D. |author3=Diaz-Bone, R. A. |year=2010|title=Organoarsenicals. Uptake, metabolism and toxicity|journal=Metal ions in life sciences|publisher=RSC publishing|location=Cambridge|volume=7|pages=231-265|isbn=978-1-84755-177-1|pmid=20877809|doi=10.1039/BK9781847551771-00231}}</ref>。例えば、カビの仲間の''Microascus brevicaulis''は、無機ヒ素が存在する環境では大量のトリメチルアルシンを生成する<ref>{{cite journal | first = Ronald | last = Bentley |author2=Chasteen, Thomas G. | title = Microbial Methylation of Metalloids: Arsenic, Antimony, and Bismuth | journal = Microbiology and Molecular Biology Reviews | year = 2002 | volume = 66 | issue = 2 | pages = 250–271 | doi = 10.1128/MMBR.66.2.250-271.2002 | pmid=12040126 | pmc=120786}}</ref>。[[ベタイン]]の1つである[[アルセノベタイン]]は、魚や海藻等の海産物、またキノコ等の食物に高濃度で含まれる。ヒトの平均の摂取量は、1日当たり約10-50 μgである。魚やキノコを食べた後には、1000 μg程度の値になることは珍しくないが、このヒ素化合物にはほぼ毒性がないため、魚を食べることにはほとんど危険性はない<ref>{{cite journal | title = Arsenic speciation in the environment | first = William R. | last = Cullen |author2=Reimer, Kenneth J. | journal = Chemical Reviews | year = 1989 | volume = 89 | issue = 4 | pages =713–764 | doi = 10.1021/cr00094a002}}</ref>。アルセノベタインは、[[オーストラリアイセエビ]]の中から初めて同定された<ref>{{cite journal | title = Arsenic Species in Marine Samples | first = Kevin A. | last = Francesconi | coauthor = John S. Edmonds Croatian Chemica Acta | volume =71 | issue = 2 | pages = 343–359 | year =1998 | url = http://public.carnet.hr/ccacaa/CCA-PDF/cca1998/v71-n2/CCA_71_1998_343_359_FRANCES.pdf}}</ref><ref>{{cite journal | title = Isolation, crystal structure and synthesis of arsenobetaine, the arsenical constituent of the western rock lobster panulirus longipes cygnus George | author = John S. Edmonds, Kevin A. Francesconi, Jack R. Cannon, Colin L. Raston, Brian W. Skelton and Allan H. White | journal = Tetrahedron Letters | volume = 18 | issue = 18 | pages = 1543-1546 | year = 1977 | doi = 10.1016/S0040-4039(01)93098-9 | url = }}</ref>。
|
||
ヒ素に結合した[[炭化水素]]は、総称して[[アルセノシュガー]]と呼ばれ、特に海藻に含まれる。ヒ素を含む[[脂質]]も知られている<ref>{{cite journal | title = Arsenic-Containing Long-Chain Fatty Acids in Cod-Liver Oil: A Result of Biosynthetic Infidelity? | author = Alice Rumpler, John S. Edmonds, Mariko Katsu, Kenneth B. Jensen, Walter Goessler, Georg Raber, Helga Gunnlaugsdottir, Kevin A. Francesconi | journal = Angew. Chem. Int. Ed. | volume = 47 | issue = | pages = 2665–2667 | year = 2008 | doi = 10.1002/anie.200705405 | url = | pmid=18306198}}</ref>。ヒ素及びその化合物はヒトにとっては有害であるが、最初に合成された抗生物質の1つは、サルバルサンである。
|
ヒ素に結合した[[炭化水素]]は、総称して[[アルセノシュガー]]と呼ばれ、特に海藻に含まれる。ヒ素を含む[[脂質]]も知られている<ref>{{cite journal | title = Arsenic-Containing Long-Chain Fatty Acids in Cod-Liver Oil: A Result of Biosynthetic Infidelity? | author = Alice Rumpler, John S. Edmonds, Mariko Katsu, Kenneth B. Jensen, Walter Goessler, Georg Raber, Helga Gunnlaugsdottir, Kevin A. Francesconi | journal = Angew. Chem. Int. Ed. | volume = 47 | issue = | pages = 2665–2667 | year = 2008 | doi = 10.1002/anie.200705405 | url = | pmid=18306198}}</ref>。ヒ素及びその化合物はヒトにとっては有害であるが、最初に合成された抗生物質の1つは、サルバルサンである。
|
||
天然から単離された唯一のポリヒ素化合物は、 |
天然から単離された唯一のポリヒ素化合物は、{{仮リンク|アルセニシンA|en|Arsenicin A}}である<ref name=Mancini>{{cite journal | doi = 10.1002/chem.200600783 | title = On the First Polyarsenic Organic Compound from Nature: Arsenicin a from the New Caledonian Marine SpongeEchinochalina bargibanti | year = 2006 | last1 = Mancini | first1 = Ines | last2 = Guella | first2 = Graziano | last3 = Frostin | first3 = Maryvonne | last4 = Hnawia | first4 = Edouard | last5 = Laurent | first5 = Dominique | last6 = Debitus | first6 = Cecile | last7 = Pietra | first7 = Francesco | journal = Chemistry - A European Journal | volume = 12 | pages = 8989-94 | pmid=17039560 | issue=35}}</ref>。これは[[ニューカレドニア]]の[[海綿]]から発見され、[[アダマンタン]]と同様の骨格構造を持つ。
|
||
==代表的な化合物== |
==代表的な化合物== |
||
| 48行目: | 48行目: | ||
|[[トリフェニルアルシン]]||[[フェニル基]]||[[File:TriphenylarsinePic.svg|100px|Triphenylarsine]]||306.23||603-32-7 ||[[融点]] 58-61 °C |
|[[トリフェニルアルシン]]||[[フェニル基]]||[[File:TriphenylarsinePic.svg|100px|Triphenylarsine]]||306.23||603-32-7 ||[[融点]] 58-61 °C |
||
|- |
|- |
||
|[フェニルジクロロアルシン]]||フェニル基, [[塩素]]||[[File:PhenyldichloroarsinePic.svg|100px]]||222.93||696-28-6|| |
|[[フェニルジクロロアルシン]]||フェニル基, [[塩素]]||[[File:PhenyldichloroarsinePic.svg|100px]]||222.93||696-28-6|| |
||
|- |
|- |
||
|[[ロキサルソン]]||||[[File:Roxarsone.png|100px]]||263.04||121-19-7|| |
|[[ロキサルソン]]||||[[File:Roxarsone.png|100px]]||263.04||121-19-7|| |
||
| 66行目: | 66行目: | ||
{{炭素との化学結合}} |
{{炭素との化学結合}} |
||
{{デフォルトソート:ゆうきひそかこうふつ}} |
|||
[[Category:有機ヒ素化合物|*]] |
[[Category:有機ヒ素化合物|*]] |
||
2024年4月19日 (金) 03:10時点における最新版
歴史[編集]
驚くことに現在はマイナーな分野と考えられている有機ヒ素化学は、化学の歴史において重要な役割を果たしてきた。既知の最も古い有機ヒ素化合物であり、不快な臭いを持つカコジルは、最初の有機金属とされることもある。サルバルサンは最初の医薬品の1つで、パウル・エールリヒにノーベル生理学・医学賞をもたらした。他のいくつかの有機ヒ素化合物も、かつては抗生物質や医薬品として用いられていた[1]。合成と分類[編集]
ヒ素は通常、IIIかVの酸化数を持ち、その化合物はAsX3 (X = F, Cl, Br, I)及びAsX5と書ける。これに対応して、有機ヒ素化合物もこの2つの酸化数で見られる[2]。有機ヒ素化合物(V)[編集]
ヒ素(V)化合物は、RAsO(OH)2またはR2AsO(OH)の官能基を持つことが多い(R = アルキル基またはアリル基)。化学式(CH3)2AsO2Hのカコジル酸は有機ヒ素化学全体において非常に重要である。これとは対照的に、ジメチルホスホン酸は、有機リン化学における重要性は少ない。カコジル酸は、三酸化二ヒ素をメチル化することで得られる。フェニルアルソン酸(C6H5AsO(OH)2)は、ベシャンプ反応と呼ばれるヒ酸とアニリンの反応により得られる。 モノメチル酸であるメタンアルソン酸(CH3AsO(OH)2)は、コメやワタの栽培の殺菌剤であるネオアソジンの前駆体である。ロキサルソン︵4-ヒドロキシ-3-ニトロベンゼンアルソン酸︶やウレイドフェニルアルソン酸、p-アルサニル酸等のフェニルアルソン酸誘導体は、家畜の餌の添加物として用いられる。環境中に可溶型のヒ素を排出する怖れがあるため、これらの用途については批判もある。 ヒ素(V)化合物で有機リガンドのみを持つものは珍しく、ほとんどはペンタフェニル誘導体As(C6H5)5である[3]。有機ヒ素化合物(III)[編集]
このカテゴリの大分部の化合物は、三塩化ヒ素(AsCl3)及びその誘導体から有機リチウムまたはグリニャール試薬を用いたアルキル化によって生成される[3]。例えば、トリメチルアルシン((CH3)3As)、塩化ジメチルアルシン((CH3)2AsCl)、二塩化メチルアルシン(CH3AsCl2)の一連の化合物が知られている。水素化還元剤による塩化物誘導体の還元により、ジメチルアルシン((CH3)2AsH)、メチルアルシン(CH3AsH2)等の対応する水素化物が得られる。同様の操作は、他の塩化有機ヒ素化合物に対しても可能である。 ジメチルアルシン化合物製造の重要なルートは、カコジル酸の還元から始まる。
 ヒ素(III)を含む様々なヘテロ環が知られている。これらには、ピロールのアナログであるアルソールやピリジンのアナログであるアルサベンゼンがある。
トリメチルアルシンやトリフェニルアルシン等の対称な有機ヒ素(III)化合物は、配位化学のリガンドとして用いられる。これらはホスフィンのリガンドのように振る舞うが、塩基性は弱い。ジアルシンC6H4(As(CH3)2)2は、キレートリガンドである。トリンは、いくつかの金属の指示薬となる。
ヒ素(III)を含む様々なヘテロ環が知られている。これらには、ピロールのアナログであるアルソールやピリジンのアナログであるアルサベンゼンがある。
トリメチルアルシンやトリフェニルアルシン等の対称な有機ヒ素(III)化合物は、配位化学のリガンドとして用いられる。これらはホスフィンのリガンドのように振る舞うが、塩基性は弱い。ジアルシンC6H4(As(CH3)2)2は、キレートリガンドである。トリンは、いくつかの金属の指示薬となる。
有機ヒ素化合物(I)[編集]
利用や数が最も少ないのは、有機ヒ素(I)化合物である。抗梅毒薬のサルバルサンやネオサルバルサンは、この分類の代表である。これらの化合物は、ヒ素原子への結合を3つ持っているが、ヒ素原子同士の結合はほぼ単結合のみである。ヒ素(I)の化合物であるがヒ素原子同士の間に二重結合を持つものはめったにない。化学兵器[編集]
特にAs-Cl結合を持つ有機ヒ素化合物は、特に第一次世界大戦中に化学兵器として用いられていた。ルイサイトやジフェニルクロロアルシン、フェニルジクロロアルシン等がある。天然[編集]
ヒ素は大部分の生命にとって有害であり、この濃度が高くなる地域もあるため、様々な解毒法が進化してきた。食物連鎖に入った無機ヒ素やその化合物は、漸進的に代謝され、メチル化されてより毒性の少ない形態になる[4]。有機ヒ素化合物は、無機ヒ素化合物が生体内でビタミンB12関連酵素により[5]メチル化されることにより生成する[6]。例えば、カビの仲間のMicroascus brevicaulisは、無機ヒ素が存在する環境では大量のトリメチルアルシンを生成する[7]。ベタインの1つであるアルセノベタインは、魚や海藻等の海産物、またキノコ等の食物に高濃度で含まれる。ヒトの平均の摂取量は、1日当たり約10-50 μgである。魚やキノコを食べた後には、1000 μg程度の値になることは珍しくないが、このヒ素化合物にはほぼ毒性がないため、魚を食べることにはほとんど危険性はない[8]。アルセノベタインは、オーストラリアイセエビの中から初めて同定された[9][10]。 ヒ素に結合した炭化水素は、総称してアルセノシュガーと呼ばれ、特に海藻に含まれる。ヒ素を含む脂質も知られている[11]。ヒ素及びその化合物はヒトにとっては有害であるが、最初に合成された抗生物質の1つは、サルバルサンである。 天然から単離された唯一のポリヒ素化合物は、アルセニシンAである[12]。これはニューカレドニアの海綿から発見され、アダマンタンと同様の骨格構造を持つ。代表的な化合物[編集]
有機ヒ素化合物の例には、以下の表のようなものがある。| 有機ヒ素化合物 | R | モル質量 | CAS登録番号 | 性質 | |
| 10,10'-オキシビス-10H-フェノキシアルシン |  |
502.2318 | 58-36-6 | ||
| トリフェニルアルシン | フェニル基 |  |
306.23 | 603-32-7 | 融点 58-61 °C |
| フェニルジクロロアルシン | フェニル基, 塩素 | 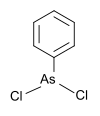 |
222.93 | 696-28-6 | |
| ロキサルソン | 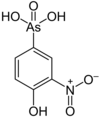 |
263.04 | 121-19-7 | ||
| アルセノベタイン | 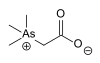 |
64436-13-1 | |||
| 代表的な有機ヒ素化合物[13] | |||||
関連項目[編集]
出典[編集]
- ^ Singh, R. Synthetic Drugs. Mittal Publications (2002).ISBN 817099831X
- ^ Sabina C. Grund, Kunibert Hanusch, Hans Uwe Wolf "Arsenic and Arsenic Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, VCH-Wiley, 2008, Weinheim.
- ^ a b Elschenbroich, C. "Organometallics" (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- ^ Reimer, K. J.; Koch, I.; Cullen, W. R. (2010). “Organoarsenicals. Distribution and transformation in the environment”. Metal ions in life sciences (Cambridge: RSC publishing) 7: 165-229. doi:10.1039/9781849730822-00165. ISBN 978-1-84755-177-1. PMID 20877808.
- ^ Toshikazu Kaise, Mitsuo Ogura, Takao Nozaki, Kazuhisa Saitoh, Teruaki Sakurai, Chiyo Matsubara, Chuichi Watanabe, Ken'ichi Hanaoka (1998). “Biomethylation of Arsenic in an Arsenic-rich Freshwater Environment”. Applied Organometallic Chemistry 11: 297–304. doi:10.1002/(SICI)1099-0739(199704)11:4<297::AID-AOC584>3.0.CO;2-0.
- ^ Dopp, E.; Kligerman, A. D.; Diaz-Bone, R. A. (2010). “Organoarsenicals. Uptake, metabolism and toxicity”. Metal ions in life sciences (Cambridge: RSC publishing) 7: 231-265. doi:10.1039/BK9781847551771-00231. ISBN 978-1-84755-177-1. PMID 20877809.
- ^ Bentley, Ronald; Chasteen, Thomas G. (2002). “Microbial Methylation of Metalloids: Arsenic, Antimony, and Bismuth”. Microbiology and Molecular Biology Reviews 66 (2): 250–271. doi:10.1128/MMBR.66.2.250-271.2002. PMC 120786. PMID 12040126.
- ^ Cullen, William R.; Reimer, Kenneth J. (1989). “Arsenic speciation in the environment”. Chemical Reviews 89 (4): 713–764. doi:10.1021/cr00094a002.
- ^ Francesconi, Kevin A.; John S. Edmonds Croatian Chemica Acta (1998). Arsenic Species in Marine Samples. 71. pp. 343–359.
- ^ John S. Edmonds, Kevin A. Francesconi, Jack R. Cannon, Colin L. Raston, Brian W. Skelton and Allan H. White (1977). “Isolation, crystal structure and synthesis of arsenobetaine, the arsenical constituent of the western rock lobster panulirus longipes cygnus George”. Tetrahedron Letters 18 (18): 1543-1546. doi:10.1016/S0040-4039(01)93098-9.
- ^ Alice Rumpler, John S. Edmonds, Mariko Katsu, Kenneth B. Jensen, Walter Goessler, Georg Raber, Helga Gunnlaugsdottir, Kevin A. Francesconi (2008). “Arsenic-Containing Long-Chain Fatty Acids in Cod-Liver Oil: A Result of Biosynthetic Infidelity?”. Angew. Chem. Int. Ed. 47: 2665–2667. doi:10.1002/anie.200705405. PMID 18306198.
- ^ Mancini, Ines; Guella, Graziano; Frostin, Maryvonne; Hnawia, Edouard; Laurent, Dominique; Debitus, Cecile; Pietra, Francesco (2006). “On the First Polyarsenic Organic Compound from Nature: Arsenicin a from the New Caledonian Marine SpongeEchinochalina bargibanti”. Chemistry - A European Journal 12 (35): 8989-94. doi:10.1002/chem.200600783. PMID 17039560.
- ^ http://www.sigmaaldrich.com
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
