不斉補助剤

不斉合成
[編集]
8-フェニルメントール
[編集]

1,1'-ビ-2-ナフトール(BINOL)
[編集]

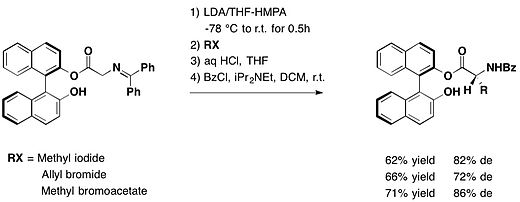
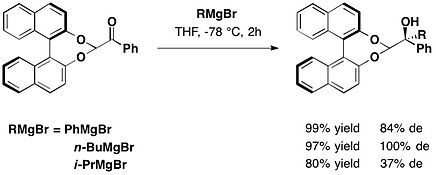
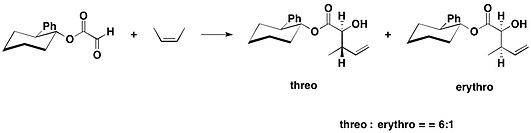
trans-2-フェニル-1-シクロヘキサノール
[編集]
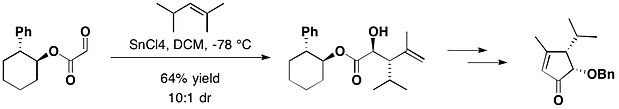

オキサゾリジノン
[編集]
調製
[編集]オキサゾリジノンは、アミノ酸およびアルカノールアミンより調製することができるが、数多くの誘導体が市販されており、一例を以下に示す。

オキサゾリジノンのアシル化は、まずn-ブチルリチウムで窒素上のプロトンを引き抜いてから、カルボン酸塩化物で処理することにより達成する。

アルキル化反応
[編集]アシルオキサゾリジノンのα炭素に結合するプロトンをリチウムジイソプロピルアミドで引き抜くことでZ体のエノラートが生成し、求電子剤を加えるとジアステレオ選択的なアルキル化が起きる[19]。強力な求電子剤であるハロゲン化アリルあるいはハロゲン化ベンジルは有効な基質となる。

アルドール反応
[編集]

除去
[編集]オキサゾリジノン補助基は簡単に取り除くことができ、以下に示す様々な官能基に変換することができる。

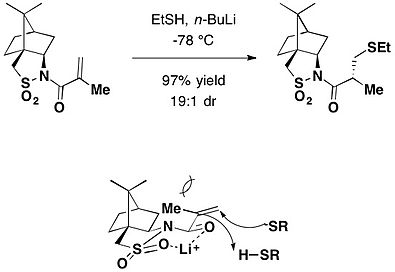
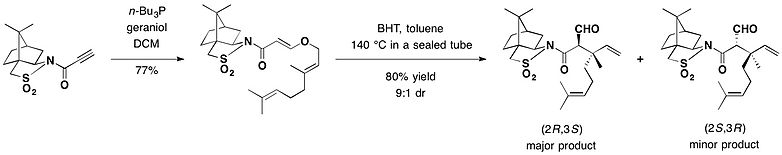
カンファースルタム
[編集]

プソイドエフェドリン
[編集]

プソイドエフェドリンの調整
[編集]アルキル化
[編集]

除去
[編集]
tert-ブタンスルフィンアミド
[編集]
カリフォルニア大学バークレー校のジョナサン・エルマンは、tert-ブタンスルフィンアミドを不斉補助剤として用いることを報告した[28]。
調製
[編集]

キラルなアミンの合成
[編集]縮合反応により得られたイミンにグリニャール試薬を添加することにより、不斉付加反応が起き、分枝構造を持つキラルなスルフィンアミドが生成する。この立体選択性は六員環遷移状態を想定することで説明できる。

除去
[編集]不斉補助剤は、プロトン性溶媒下で塩酸処理を行うことにより除くことができ、対応するアミンが生成する。

SAMP/RAMP
[編集](S)-1-アミノ-2-メトキシメチルピロリジン(SAMP)および(R)-1-アミノ-2-メトキシメチルピロリジン(RMAP)のヒドラゾン化合物は、イライアス・コーリーらによって開発された不斉補助剤である[29][30]。
調製
[編集]SAMPはL-プロリンから6段階、RAMPはD-グルタミン酸から6段階のステップを経て合成される。

アルキル化反応
[編集]SAMPおよびRAMPとアルデヒドまたはケトンの縮合反応により、E体のヒドラジン化合物が生成する。この化合物にリチウムジイソプロピルアミドを加えてプロトンを引き抜き、求電子剤としてハロゲン化アルキルを加えると、イミンのα位がジアステレオ選択的にアルキル化された生成物が得られる。不斉補助剤は、オゾン分解または酸加水分解により分離することができる。

工業的に利用されている不斉補助剤
[編集]不斉補助剤を用いた不斉合成は、短時間で数々のエナンチオピュアな化合物を得ることができるため、便利であり信頼できる手法である。したがって不斉補助剤は、医薬品開発の初期段階において頻繁に用いられてきた[2]。
チプラナビル
[編集]
アトルバスタチン
[編集]
脚注
[編集]- ^ Key Chiral Auxiliary Applications (Second Edition)(ed.: Roos, G.), Academic Press, Boston, 2014. ISBN 978-0-12-417034-6.
- ^ a b c Glorius, F.; Gnas, Y. (2006). “Chiral Auxiliaries — Principles and Recent Applications”. Synthesis 12: 1899–1930. doi:10.1055/s-2006-942399.
- ^ Jamali, Fakhreddin (1993). “Chapter 14: Stereochemically Pure Drugs: An Overview”. In Wainer, Irving W.. Drug Stereochemistry: Analytical Methods and Pharmacology. Marcel Dekker, Inc.. pp. 375–382. ISBN 0-8247-8819-2
- ^ a b Evans, D. A.; Helmchen, G.; Rüping, M. (2007). “Chiral Auxiliaries in Asymmetric Synthesis”. In Christmann, M. Asymmetric Synthesis — The Essentials. Wiley-VCH Verlag GmbH & Co.. pp. 3–9. ISBN 978-3-527-31399-0
- ^ a b Corey, E. J.; Ensley, H. E. (1975). “Preparation of an Optically Active Prostaglandin Intermediate via Asymmetric Induction”. J. Am. Chem. Soc. 97 (23): 6908–6909. doi:10.1021/ja00856a074.
- ^ Nicolau, K. C. (2008). Classics in Total Synthesis (5th ed.). New York, New York: Wiley-VCH. pp. 485–508. ISBN 978-3-527-29231-8
- ^ Miller, J. P. (2013). “ChemInform Abstract: Recent Advances in Asymmetric Diels-Alder Reactions”. ChemInform 44 (48). doi:10.1002/chin.201348243.
- ^ Corey, E. J.; Ensley, H. E.; Parnell, C. A. (1978). “Convenient Synthesis of a Highly Efficient and Recyclable Chiral Director for Asymmetric Induction”. J. Org. Chem. 43 (8): 1610–1611. doi:10.1021/jo00402a037.
- ^ Whitesell, J. K.; Chen, H. H.; Lawrence, R. M. (1985). “trans-2-Phenylcyclohexanol. A powerful and readily available chiral auxiliary”. J. Org. Chem. 50 (23): 4663–4664. doi:10.1021/jo00223a055.
- ^ Comins, D. L; Salvador, J. D. (1993). “Efficient Synthesis and Resolution of trans-2-( 1-Aryl-1-methylethyl)cyclohexanols: Practical Alternatives to 8-P henylmenthol”. J. Org. Chem. 58 (17): 4656–4661. doi:10.1021/jo00069a031.
- ^ Brunel, Jean Michel. “BINOL: A Versatile Chiral Reagent”. Chemical Reviews 105 (3): 857–898. doi:10.1021/cr040079g.
- ^ a b Sakane, Soichi; Fujiwara, Junya; Maruoka, Keiji; Yamamoto, Hisashi. “Chiral leaving group. Biogenetic-type asymmetric synthesis of limonene and bisabolenes”. Journal of the American Chemical Society 105 (19): 6154–6155. doi:10.1021/ja00357a033.
- ^ Tanaka, Kiyoshi; Ahn, Mija; Watanabe, Yukari; Fuji, Kaoru (1996-06-01). “Asymmetric synthesis of uncommon α-amino acids by diastereoselective alkylations of a chiral glycine equivalent”. Tetrahedron: Asymmetry 7 (6): 1771–1782. doi:10.1016/0957-4166(96)00212-1.
- ^ Maglioli, Paola; De Lucchi, Ottorino; Delogu, Giovanna; Valle, Giovanni (1992-01-01). “Highly diastereoselective reduction and addition of nucleophiles to binaphthol-protected arylglyoxals”. Tetrahedron: Asymmetry 3 (3): 365–366. doi:10.1016/S0957-4166(00)80276-1.
- ^ Buchi, George; Vogel, Dennis E.. “A new method for the preparation of .gamma.,.delta.-unsaturated ketones via Claisen rearrangement”. The Journal of Organic Chemistry 50 (23): 4664–4665. doi:10.1021/jo00223a056.
- ^ Miller, Aubry K.; Hughes, Chambers C.; Kennedy-Smith, Joshua J.; Gradl, Stefan N.; Trauner, Dirk. “Total Synthesis of (−)-Heptemerone B and (−)-Guanacastepene E”. Journal of the American Chemical Society 128 (51): 17057–17062. doi:10.1021/ja0660507.
- ^ Al Hazmi, Ali M.; Sheikh, Nadeem S.; Bataille, Carole J. R.; Al-Hadedi, Azzam A. M.; Watkin, Sam V.; Luker, Tim J.; Camp, Nicholas P.; Brown, Richard C. D.. “trans -2-Tritylcyclohexanol as a Chiral Auxiliary in Permanganate-Mediated Oxidative Cyclization of 2-Methylenehept-5-enoates: Application to the Synthesis of trans -(+)-Linalool Oxide”. Organic Letters 16 (19): 5104–5107. doi:10.1021/ol502454r.
- ^ a b Evans, D. A.; Bartroli, J.; Shih, T. L (1981). “Enantioselective aldol condensations. 2. Erythro-selective chiral aldol condensations via boron enolates”. J. Am. Chem. Soc. 103 (8): 2127–2129. doi:10.1021/ja00398a058.
- ^ a b Evans, D. A.; Ennis, M D.; Mathre, D. J. (1982). “Asymmetric Alkylation Reactions of Chiral Imide Enolates. A Practical Approach to the Enantioselective Synthesis of a-Substituted Carboxylic Acid Derivatives”. J. Am. Chem. Soc. 104 (6): 1737–1739. doi:10.1021/ja00370a050.
- ^ Evans, D. A.; Chapman, K. T.; Bisaha, J. (1984). “New Asymmetric Diels-Alder Cycloaddition Reactions. Chiral α,β-Unsaturated Carboximides as Practical Chiral Acrylate and Crotonate Dienophile Synthons”. J. Am. Chem. Soc. 106 (15): 4261–4263. doi:10.1021/ja00327a031.
- ^ Evans, D. A.; Chapman, K. T.; Hung, D. T.; Kawaguchi, A. T. (1987). “Transition State π-Solvation by Aromatic Rings: An Electronic Contribution to Diels-Alder Reaction Diastereoselectivity”. Angew. Chem. Int. Ed. 26 (11): 1184–1186. doi:10.1002/anie.198711841.
- ^ Shinada, Tetsuro; Oe, Kentaro; Ohfune, Yasufumi (2012-06-27). “Efficient total synthesis of manzacidin B”. Tetrahedron Letters 53 (26): 3250–3253. doi:10.1016/j.tetlet.2012.04.042.
- ^ Tsai, Wen-Jiuan; Lin, Yi-Tsong; Uang, Biing-Jiun (1994-07-01). “Asymmetric Michael addition of thiols to (1R,2R,4R)-(−)-2,10-N-enoylcamphorsultam”. Tetrahedron: Asymmetry 5 (7): 1195–1198. doi:10.1016/0957-4166(94)80155-X.
- ^ Takao, Ken-ichi; Sakamoto, Shu; Touati, Marianne Ayaka; Kusakawa, Yusuke; Tadano, Kin-ichi (2012-11-08). “Asymmetric Construction of All-Carbon Quaternary Stereocenters by Chiral-Auxiliary-Mediated Claisen Rearrangement and Total Synthesis of (+)-Bakuchiol” (英語). Molecules 17 (11): 13330–13344. doi:10.3390/molecules171113330.
- ^ Myers, A. G., et al., Pseudoephedrine as a Practical Chiral Auxiliary for the Synthesis of Highly Enantiomerically Enriched Carboxylic Acids, Alcohols, Aldehydes, and Ketones, J. Am. Chem. Soc., 1997, 119, 6496-6511.doi:10.1021/ja970402f
- ^ Myers, A. G.; Morales, M. R.; Mellem, K. T. (2012). “Pseudoephenamine: A Practical Chiral Auxiliary for Asymmetric Synthesis”. Angew. Chem. 124: 4646–4649. doi:10.1002/ange.201200370.
- ^ Kummer, D. A.; Chain, W. J.; Morales, M. R.; Quiroga, O.; Myers, A. G. (2008). “Stereocontrolled Alkylative Construction of Quaternary Carbon Centers”. J. Am. Chem. Soc. 130: 13231–13233. doi:10.1021/ja806021y.
- ^ Ellman, J. A.; Owens, T. D.; Tang, T. P. (2002). “N-tert-Butanesulfinyl Imines: Versatile Intermediates for the Asymmetric Synthesis of Amines”. Acc. Chem. Res. 35: 984–995. doi:10.1021/ar020066u.
- ^ Corey, E. J.; Enders, D. (1976). “Applications of N,N-dimethylhydrazones to synthesis. Use in efficient, positionally and stereochemically selective C-C bond formation; oxidative hydrolysis to carbonyl compounds”. Tetrahedron Letters 17 (1): 3–6. doi:10.1016/s0040-4039(00)71307-4.
- ^ Kurti, L.; Czako, B. (2005). Strategic Applications of Named Reactions in Organic Synthesis. Burlington, MA: Elsevier Academic Press. pp. 150–151. ISBN 0-12-369483-3
- ^ Turner, S. T. (1998). “Tipranavir (PNU-140690): A Potent, Orally Bioavailable Nonpeptidic HIV Protease Inhibitor of the 5,6-Dihydro-4-hydroxy-2-pyrone Sulfonamide Class”. J. Med. Chem. 41: 3467–3476. doi:10.1021/jm9802158.
- ^ Caron, Stéphane (2011). “Chapter 15: Synthetic Route Development of Selected Contemporary Pharmaceutical Drugs”. In Caron, Stéphane. Practical Synthetic Organic Chemistry. John Wiley & Sons, Inc.. pp. 666–670. ISBN 978-0-470-03733-1
- ^ Roth, B. D. ' (1991). “Inhibitors of Cholesterol Biosynthesis. 3. Tetrahydro-4-hydroxy-6-[2-( lH-pyrrol-l-yl)ethyl]-2H-pyran-2-one Inhibitors of HMG-CoA Reductase. 2. Effects of Introducing Substituents at Positions Three and Four of the Pyrrole Nucleus”. J. Med. Chem. 34: 357–366. doi:10.1021/jm00105a056.
- ^ Jie Jack Li, Douglas S. Johnson, Drago R. Sliskovic, Bruce D. Roth (2004). “Chapter 9. Atorvastatin Calcium (Lipitor)”. Contemporary Drug Synthesis. John Wiley & Sons, Inc.. pp. 113–125. ISBN 0-471-21480-9
