硝酸
窒素のオキソ酸
硝酸︵しょうさん、英: nitric acid、独: Salpetersäure︶は窒素のオキソ酸で、化学式 HNO3 で表される。代表的な強酸の1つで、様々な金属と反応して塩を形成する。有機化合物のニトロ化に用いられる。硝酸は消防法第2条第7項及び別表第一第6類3号により危険物第6類に指定され、硝酸を 10 % 以上含有する溶液は医薬用外劇物にも指定されている。
| 硝酸 | |
|---|---|

|
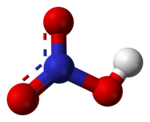
|
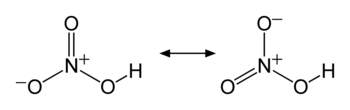 共鳴構造式
| |

| |
Nitric acid | |
| 識別情報 | |
| CAS登録番号 | 7697-37-2 |
| PubChem | 944 |
| ChemSpider | 919 |
| UNII | 411VRN1TV4 |
| EC番号 | 231-714-2 |
| 国連/北米番号 | 2031 |
| KEGG | D02313 C00244 |
| MeSH | Nitric+acid |
| ChEBI | |
| ChEMBL | CHEMBL1352 |
| RTECS番号 | QU5775000 |
| Gmelin参照 | 1576 |
| 3DMet | B00068 |
| |
| |
| 特性 | |
| 化学式 | HNO3 |
| 精密質量 | 62.995642903 g mol-1 |
| 外観 | 無色の液体 |
| 密度 | 1.5129 g cm-3 |
| 融点 |
-41.6 °C, 232 K, -43 °F |
| 沸点 |
82.6 °C, 356 K, 181 °F (68 % 溶液は 121 °Cで沸騰) |
| 水への溶解度 | 完全に溶解 |
| 酸解離定数 pKa | -1.4 |
| 屈折率 (nD) | 1.397 (16.5 ℃) |
| 双極子モーメント | 2.17 ± 0.02 D |
| 危険性 | |
| 安全データシート(外部リンク) | 厚生労働省モデルSDS |
| GHSピクトグラム |     [1] [1]
|
| GHSシグナルワード | 危険 [1] |
| Hフレーズ | |
| NFPA 704 | |
| 引火点 | 不燃性 |
| 関連する物質 | |
| その他の陰イオン | 亜硝酸 |
| その他の陽イオン | 硝酸ナトリウム 硝酸カリウム 硝酸アンモニウム |
| 関連物質 | 五酸化二窒素 |
| 出典 | |
| ICSC | |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
概要
編集
五酸化二窒素︵無水硝酸、N2O5︶を水に溶かすと得られる、一価の強酸性の液体で、金属と反応して硝酸塩︵水に可溶︶を作る。任意の割合で水に溶け、通常﹁硝酸﹂という場合には水溶液を指す。
 濃度の低い硝酸を希硝酸という[注1]。市販の濃硝酸は 60 %︵d = 1.360 g cm-3, 13.0 mol dm-3︶あるいは 70 % (d = 1.406 g cm-3, 15.6 mol dm−3) の水溶液が普通である。69.8 % の水溶液は共沸混合物となり 123 ℃で沸騰する。
濃硝酸と濃硫酸の混合物である混酸を用いたニトロ化合物の合成などから爆薬が作られ、他にも染料、肥料などの製造に用いる。
濃度の低い硝酸を希硝酸という[注1]。市販の濃硝酸は 60 %︵d = 1.360 g cm-3, 13.0 mol dm-3︶あるいは 70 % (d = 1.406 g cm-3, 15.6 mol dm−3) の水溶液が普通である。69.8 % の水溶液は共沸混合物となり 123 ℃で沸騰する。
濃硝酸と濃硫酸の混合物である混酸を用いたニトロ化合物の合成などから爆薬が作られ、他にも染料、肥料などの製造に用いる。
 濃度の低い硝酸を希硝酸という[注1]。市販の濃硝酸は 60 %︵d = 1.360 g cm-3, 13.0 mol dm-3︶あるいは 70 % (d = 1.406 g cm-3, 15.6 mol dm−3) の水溶液が普通である。69.8 % の水溶液は共沸混合物となり 123 ℃で沸騰する。
濃硝酸と濃硫酸の混合物である混酸を用いたニトロ化合物の合成などから爆薬が作られ、他にも染料、肥料などの製造に用いる。
濃度の低い硝酸を希硝酸という[注1]。市販の濃硝酸は 60 %︵d = 1.360 g cm-3, 13.0 mol dm-3︶あるいは 70 % (d = 1.406 g cm-3, 15.6 mol dm−3) の水溶液が普通である。69.8 % の水溶液は共沸混合物となり 123 ℃で沸騰する。
濃硝酸と濃硫酸の混合物である混酸を用いたニトロ化合物の合成などから爆薬が作られ、他にも染料、肥料などの製造に用いる。
化学的性質
編集
強酸化剤で、木炭の粉末とともに熱すれば木炭は酸化されて二酸化炭素となる。
 二酸化窒素や四酸化二窒素を吸収させて発煙硝酸や赤煙硝酸とし、ロケットエンジンの推進剤の酸化剤として用いられる。有機系の燃料と混合するだけで点火する。
硝酸に触れるとキサントプロテイン反応によって皮膚が黄変する。
光に弱く、長時間光を浴び続けると分解し黄色を帯びる。
二酸化窒素や四酸化二窒素を吸収させて発煙硝酸や赤煙硝酸とし、ロケットエンジンの推進剤の酸化剤として用いられる。有機系の燃料と混合するだけで点火する。
硝酸に触れるとキサントプロテイン反応によって皮膚が黄変する。
光に弱く、長時間光を浴び続けると分解し黄色を帯びる。
![{\displaystyle {\ce {4HNO3->[{\mathit {h}}\nu ]4NO2{}+2H2O{}+O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/318b60636c29bcdba53d69e39b16fa519ec70344) そのため褐色瓶中で保管する。
そのため褐色瓶中で保管する。
 二酸化窒素や四酸化二窒素を吸収させて発煙硝酸や赤煙硝酸とし、ロケットエンジンの推進剤の酸化剤として用いられる。有機系の燃料と混合するだけで点火する。
硝酸に触れるとキサントプロテイン反応によって皮膚が黄変する。
光に弱く、長時間光を浴び続けると分解し黄色を帯びる。
二酸化窒素や四酸化二窒素を吸収させて発煙硝酸や赤煙硝酸とし、ロケットエンジンの推進剤の酸化剤として用いられる。有機系の燃料と混合するだけで点火する。
硝酸に触れるとキサントプロテイン反応によって皮膚が黄変する。
光に弱く、長時間光を浴び続けると分解し黄色を帯びる。
![{\displaystyle {\ce {4HNO3->[{\mathit {h}}\nu ]4NO2{}+2H2O{}+O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/318b60636c29bcdba53d69e39b16fa519ec70344) そのため褐色瓶中で保管する。
そのため褐色瓶中で保管する。
金属に対する反応
編集
希塩酸とは異なり、酸化作用により希硝酸であっても水素よりイオン化傾向の小さい金属を溶かすことが可能である。白金、金を溶かすことはできないが、濃硝酸と濃塩酸を混ぜて王水を作ることにより、これらの金属も溶かすことが可能になる。また、アルミニウム、クロムおよび鉄などは濃硝酸中で表面に酸化皮膜を形成し不動態が形成されるため反応が進行しない。
極めて薄い硝酸水溶液の場合、マグネシウムは初期において水素ガスを発生する[2]。
 しかし、希硝酸中であっても亜鉛などの比較的イオン化傾向の大きな金属は硝酸イオンをアンモニウムイオンまで還元する[3]。
しかし、希硝酸中であっても亜鉛などの比較的イオン化傾向の大きな金属は硝酸イオンをアンモニウムイオンまで還元する[3]。
 また希硝酸はよりイオン化傾向の小さな金属の場合は主に一酸化窒素を発生する。
また希硝酸はよりイオン化傾向の小さな金属の場合は主に一酸化窒素を発生する。
 濃硝酸では二酸化窒素の発生が主反応となり、発熱により反応は次第に激しくなる。
濃硝酸では二酸化窒素の発生が主反応となり、発熱により反応は次第に激しくなる。
 しかし、希硝酸中であっても亜鉛などの比較的イオン化傾向の大きな金属は硝酸イオンをアンモニウムイオンまで還元する[3]。
しかし、希硝酸中であっても亜鉛などの比較的イオン化傾向の大きな金属は硝酸イオンをアンモニウムイオンまで還元する[3]。
 また希硝酸はよりイオン化傾向の小さな金属の場合は主に一酸化窒素を発生する。
また希硝酸はよりイオン化傾向の小さな金属の場合は主に一酸化窒素を発生する。
 濃硝酸では二酸化窒素の発生が主反応となり、発熱により反応は次第に激しくなる。
濃硝酸では二酸化窒素の発生が主反応となり、発熱により反応は次第に激しくなる。
ニトロ化反応
編集
硝酸は硫酸中では塩基として挙動しプロトン化を受け、脱水によりニトロイルイオン (nitroyl / NO2+) を生成する。濃硝酸と濃硫酸を混合した混酸中では以下のような化学平衡が成立している。

 このニトロイルイオンが芳香族化合物などに対し求電子置換反応を起こしニトロ化が進行する。
このニトロイルイオンが芳香族化合物などに対し求電子置換反応を起こしニトロ化が進行する。

 このニトロイルイオンが芳香族化合物などに対し求電子置換反応を起こしニトロ化が進行する。
このニトロイルイオンが芳香族化合物などに対し求電子置換反応を起こしニトロ化が進行する。
純硝酸の性質
編集
純粋な遊離酸も 0 ℃で硝酸カリウムと純硫酸を反応させ、真空蒸留により単離することが可能である。
 しかし不安定であり光反応などにより分解し、二酸化窒素などを発生させる[2]。
純硝酸は遊離酸として知られているものの中ではもっとも強く自己解離し、さらに生成するリオニウムイオンは脱水されニトロイルイオンとなり、その平衡定数は25℃ で以下のようである
しかし不安定であり光反応などにより分解し、二酸化窒素などを発生させる[2]。
純硝酸は遊離酸として知られているものの中ではもっとも強く自己解離し、さらに生成するリオニウムイオンは脱水されニトロイルイオンとなり、その平衡定数は25℃ で以下のようである


![{\displaystyle {\ce {K=[NO2^{+}][NO3^{-}][H2O]\ =\ 7\times 10^{-2}mol^{3}~L^{-3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a519af974d3108de2ea0fa0c4cfca4217db52c9) 高い電気伝導度を示し、25℃ における比電気伝導度は 3.72 × 10−2 Ω−1cm−1 であり、純硫酸よりさらに高い[2]。
また、純硝酸のハメットの酸度関数は H0 = − 6.3 であり純硫酸などに比べるとかなり酸性度は低い[4]。
高い電気伝導度を示し、25℃ における比電気伝導度は 3.72 × 10−2 Ω−1cm−1 であり、純硫酸よりさらに高い[2]。
また、純硝酸のハメットの酸度関数は H0 = − 6.3 であり純硫酸などに比べるとかなり酸性度は低い[4]。
 しかし不安定であり光反応などにより分解し、二酸化窒素などを発生させる[2]。
純硝酸は遊離酸として知られているものの中ではもっとも強く自己解離し、さらに生成するリオニウムイオンは脱水されニトロイルイオンとなり、その平衡定数は25℃ で以下のようである
しかし不安定であり光反応などにより分解し、二酸化窒素などを発生させる[2]。
純硝酸は遊離酸として知られているものの中ではもっとも強く自己解離し、さらに生成するリオニウムイオンは脱水されニトロイルイオンとなり、その平衡定数は25℃ で以下のようである


![{\displaystyle {\ce {K=[NO2^{+}][NO3^{-}][H2O]\ =\ 7\times 10^{-2}mol^{3}~L^{-3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a519af974d3108de2ea0fa0c4cfca4217db52c9) 高い電気伝導度を示し、25℃ における比電気伝導度は 3.72 × 10−2 Ω−1cm−1 であり、純硫酸よりさらに高い[2]。
また、純硝酸のハメットの酸度関数は H0 = − 6.3 であり純硫酸などに比べるとかなり酸性度は低い[4]。
高い電気伝導度を示し、25℃ における比電気伝導度は 3.72 × 10−2 Ω−1cm−1 であり、純硫酸よりさらに高い[2]。
また、純硝酸のハメットの酸度関数は H0 = − 6.3 であり純硫酸などに比べるとかなり酸性度は低い[4]。
硝酸の水和
編集硝酸の第一水和エンタルピー変化および溶解エンタルピー変化は以下の通りであり、過塩素酸および硫酸などより発熱量は少ない[5]。
水溶液中の電離平衡
編集
硝酸は水溶液中では強酸として挙動し、0.1 mol/dm3 程度の水溶液ではほぼ完全に解離し塩酸および過塩素酸などと電離度に大きな差は認められないが、濃厚溶液ではこれらの酸との電離度に差が認められ、2 - 4 mol/dm3 溶液については糖転化の触媒作用についてこれらより弱いことが示され、非解離の硝酸分子が存在することが示されている[6][7]。
濃厚溶液中における非解離の硝酸分子の濃度とデバイ-ヒュッケルの拡張理論などから硝酸の酸解離定数は K= 21 (pKa = −1.32) と求められ、またメタノール中 (pKa = 3.2) の値より水中では pKa= −1.8 とする推定値もある[8]。
また、水溶液中の解離に関する熱力学的な数値も報告されており、そのギブスの自由エネルギー変化によればpKa = −1.44である[9]。
| −13.81 kJ mol−1 | −8.24 kJ mol−1 | −18.4 J mol−1 K−1 |
歴史
編集
8世紀のアラビアの科学者ジャービル・イブン=ハイヤーンによって緑礬 FeSO4・7H2Oまたは明礬 KAl(SO4)2・12H2Oと硝石 KNO3 とを混ぜて蒸留によって合成されることが発見された。17世紀にはいってヨハン・ルドルフ・グラウバーがこれを改良し、硫酸と硝石との混合物を蒸留し、純粋な硝酸を作っている。銅・銀などをも溶かし金属に対する作用は硫酸よりも強いということから、強い水という意味のラテン語をとり aqua fortis と呼ばれた。イギリスでは硝石の精という意味の spirit of nitre ともいわれていた。硝酸という言葉は1789年にアントワーヌ・ラヴォアジエによってフランス語で acide nitrique と命名されて以来用いられるようになった。
工業的製法
編集2016年度日本国内生産量は 363,308 t、消費量は 213,080 t である(98%換算)[10] 。ヴィルヘルム・オストヴァルト考案のオストワルト法(アンモニア酸化法とも[11])による生産が一般的である。
オストワルト法
編集
アンモニアを白金触媒の存在下で 900 ℃ 程度に加熱すると一酸化窒素が得られる。この反応においては触媒とアンモニアの接触時間が重要であり、接触時間が長いとアンモニアと一酸化窒素とが反応して窒素が生成されてしまう[11]。触媒にはこのほかに CuO-MnO2 系や、Fe2O3-Bi2O3 系などの金属酸化物触媒も、かつては用いられたことがあったが、触媒活性で劣っていたり、反応中に触媒が微粉化してしまうため、現在では、白金に 10 % ほどのロジウムを加えた金網状の触媒が用いられている。白金-ロジウム触媒を用いた際には反応温度 800 °C、接触時間 0.001 秒の反応条件で一酸化窒素への転化が起こり、その収率は 95 – 98 % である[11]。そのほかに粘土によっても酸化に成功した事例もあるが、収率は半分以下である。
 一酸化窒素は自発的に空気中の酸素と反応し二酸化窒素となる。空気酸化によるこの工程での収率はおよそ 50 % であり、純粋な酸素を用いて酸化させることでその収率は 62 % まで向上する[11]。
一酸化窒素は自発的に空気中の酸素と反応し二酸化窒素となる。空気酸化によるこの工程での収率はおよそ 50 % であり、純粋な酸素を用いて酸化させることでその収率は 62 % まで向上する[11]。
 二酸化窒素を水︵温水︶と反応させると硝酸と一酸化窒素が発生する︵一酸化窒素は最初のサイクルに戻る︶︵冷水との反応は﹁二酸化窒素﹂を参照︶。常圧で反応させた場合は硝酸の濃度が低いため、ポーリング式硝酸濃縮法と呼ばれる方法を用いて硝酸濃度が 98 %になるまで濃縮が行われる。また、10気圧 (106 Pa) ほどの圧力を加えて反応させる高圧法を用いれば、濃縮の必要なく直接 98 %の硝酸が得られる[11]。
二酸化窒素を水︵温水︶と反応させると硝酸と一酸化窒素が発生する︵一酸化窒素は最初のサイクルに戻る︶︵冷水との反応は﹁二酸化窒素﹂を参照︶。常圧で反応させた場合は硝酸の濃度が低いため、ポーリング式硝酸濃縮法と呼ばれる方法を用いて硝酸濃度が 98 %になるまで濃縮が行われる。また、10気圧 (106 Pa) ほどの圧力を加えて反応させる高圧法を用いれば、濃縮の必要なく直接 98 %の硝酸が得られる[11]。
 全体として、
全体として、
 窒素酸化物は大気中でもこのような反応を起こし、酸性雨の原因の一つとなる。ただし僅かなレベルであれば植物の栄養源となる。
窒素酸化物は大気中でもこのような反応を起こし、酸性雨の原因の一つとなる。ただし僅かなレベルであれば植物の栄養源となる。
 一酸化窒素は自発的に空気中の酸素と反応し二酸化窒素となる。空気酸化によるこの工程での収率はおよそ 50 % であり、純粋な酸素を用いて酸化させることでその収率は 62 % まで向上する[11]。
一酸化窒素は自発的に空気中の酸素と反応し二酸化窒素となる。空気酸化によるこの工程での収率はおよそ 50 % であり、純粋な酸素を用いて酸化させることでその収率は 62 % まで向上する[11]。
 二酸化窒素を水︵温水︶と反応させると硝酸と一酸化窒素が発生する︵一酸化窒素は最初のサイクルに戻る︶︵冷水との反応は﹁二酸化窒素﹂を参照︶。常圧で反応させた場合は硝酸の濃度が低いため、ポーリング式硝酸濃縮法と呼ばれる方法を用いて硝酸濃度が 98 %になるまで濃縮が行われる。また、10気圧 (106 Pa) ほどの圧力を加えて反応させる高圧法を用いれば、濃縮の必要なく直接 98 %の硝酸が得られる[11]。
二酸化窒素を水︵温水︶と反応させると硝酸と一酸化窒素が発生する︵一酸化窒素は最初のサイクルに戻る︶︵冷水との反応は﹁二酸化窒素﹂を参照︶。常圧で反応させた場合は硝酸の濃度が低いため、ポーリング式硝酸濃縮法と呼ばれる方法を用いて硝酸濃度が 98 %になるまで濃縮が行われる。また、10気圧 (106 Pa) ほどの圧力を加えて反応させる高圧法を用いれば、濃縮の必要なく直接 98 %の硝酸が得られる[11]。
 全体として、
全体として、
 窒素酸化物は大気中でもこのような反応を起こし、酸性雨の原因の一つとなる。ただし僅かなレベルであれば植物の栄養源となる。
窒素酸化物は大気中でもこのような反応を起こし、酸性雨の原因の一つとなる。ただし僅かなレベルであれば植物の栄養源となる。
硝酸イオン
編集
 硝酸イオン︵しょうさんイオン、NO3−, nitrate︶は硝酸およびその化合物の電離、分解によって主に生じる1価の陰イオン、窒素化合物であり、硝酸塩中にも存在し、平面正三角形型構造で N−O 結合距離は硝酸三水和物中において 124.7 – 126.5 pmである[8]。
硝酸は強い酸化剤であり、多くの金属と反応するため多種の塩を生成する。また一般に、金属の硝酸塩は水に溶解しやすい。
希薄水溶液中における標準酸化還元電位は以下の通りである。
硝酸イオン︵しょうさんイオン、NO3−, nitrate︶は硝酸およびその化合物の電離、分解によって主に生じる1価の陰イオン、窒素化合物であり、硝酸塩中にも存在し、平面正三角形型構造で N−O 結合距離は硝酸三水和物中において 124.7 – 126.5 pmである[8]。
硝酸は強い酸化剤であり、多くの金属と反応するため多種の塩を生成する。また一般に、金属の硝酸塩は水に溶解しやすい。
希薄水溶液中における標準酸化還元電位は以下の通りである。



 硝酸イオンは白金電極を用いた水溶液の電解により陰極でアンモニアまで還元される。
硝酸イオンは白金電極を用いた水溶液の電解により陰極でアンモニアまで還元される。
硝酸塩
編集詳細は「硝酸塩」を参照
消防法により硝酸塩類は危険物 第1類 酸化性固体に分類される。硝酸イオンは本来無色透明であるが、遷移金属イオンを含むものは有色であることが多い。
主に火薬、肥料、食品添加物︵発色剤︶などに用いられる。
- 硝酸カリウム (KNO3)
- 硝酸ナトリウム (NaNO3)
- 硝酸アンモニウム (NH4NO3)
- 硝酸ウラニル (UO2(NO3)2)
- 硝酸カルシウム (Ca(NO3)2)
- 硝酸銀 (AgNO3)
- 硝酸鉄(II) (Fe(NO3)2)
- 硝酸鉄(III) (Fe(NO3)3)
- 硝酸銅(II) (Cu(NO3)2)
- 硝酸鉛(II) (Pb(NO3)2)
- 硝酸バリウム (Ba(NO3)2)
硝酸塩鉱物
編集生態系における硝酸
編集脚注
編集注釈
編集- ^ 濃度は特に定義されているわけではないが、実験室で用いる希硝酸は通常 6 mol/dm3 (32 %, d = 1.19 g · cm-3)、あるいはそれ以下のものであることが多い。
出典
編集- ^ a b c 厚生労働省モデルSDS
- ^ a b c FA コットン, G. ウィルキンソン著, 中原 勝儼訳 『コットン・ウィルキンソン無機化学』 培風館、1987年,原書:F. ALBERT COTTON and GEOFFREY WILKINSON, Cotton and Wilkinson ADVANCED INORGANIC CHEMISTRY A COMPREHENSIVE TEXT Fourth Edition, INTERSCIENCE, 1980.
- ^ D.F.SHRIVER, P.W.ATKINS, INORGANIC CHEMISTRY Third Edition, 1999.
- ^ シャロー 『溶液内の化学反応と平衡』 藤永太一郎、佐藤昌憲訳、丸善、1975年
- ^ D.D. Wagman, W.H. Evans, V.B. Parker, R.H. Schumm, I. Halow, S.M. Bailey, K.L. Churney, R.I. Nuttal, K.L. Churney and R.I. Nuttal, The NBS tables of chemical thermodynamics properties, J. Phys. Chem. Ref. Data 11 Suppl. 2 (1982)
- ^ 山崎一雄他 『無機溶液化学』 南江堂、1968年
- ^ 化学大辞典編集委員会 『化学大辞典』 共立出版、1993年
- ^ a b 『改訂4版化学便覧基礎編Ⅱ』 日本化学会編、丸善、1993年
- ^ 田中元治 『基礎化学選書8 酸と塩基』 裳華房、1971年
- ^ 経済産業省生産動態統計年報 化学工業統計編
- ^ a b c d e 米田幸夫 著、化学大辞典編集委員会(編) 編『化学大辞典』 1巻(縮刷版第26版)、共立、1981年10月、531-532頁頁。
