酵素
表示
この記事は英語版の対応するページを翻訳することにより充実させることができます。(2021年8月) 翻訳前に重要な指示を読むには右にある[表示]をクリックしてください。
●英語版記事を日本語へ機械翻訳したバージョン︵Google翻訳︶。
●万が一翻訳の手がかりとして機械翻訳を用いた場合、翻訳者は必ず翻訳元原文を参照して機械翻訳の誤りを訂正し、正確な翻訳にしなければなりません。これが成されていない場合、記事は削除の方針G-3に基づき、削除される可能性があります。
●信頼性が低いまたは低品質な文章を翻訳しないでください。もし可能ならば、文章を他言語版記事に示された文献で正しいかどうかを確認してください。
●履歴継承を行うため、要約欄に翻訳元となった記事のページ名・版について記述する必要があります。記述方法については、Wikipedia:翻訳のガイドライン#要約欄への記入を参照ください。
●翻訳後、 {{翻訳告知|en|Enzyme|…}}をノートに追加することもできます。
●Wikipedia:翻訳のガイドラインに、より詳細な翻訳の手順・指針についての説明があります。
|

| 生化学 |
|---|
 |
酵素︵こうそ、英: enzyme︶とは、生体内外で起こる化学反応に対して触媒として機能する分子である。酵素によって触媒される反応を﹁酵素的﹂反応という。このことについて酵素の構造や反応機構を研究する古典的な学問領域が、酵素学︵こうそがく、英: enzymology︶である。
酵素は生物が物質を消化する段階から吸収・分布・代謝・排泄に至るまでのあらゆる過程︵ADME︶に関与しており、生体が物質を変化させて利用するのに欠かせない。したがって、酵素は生化学研究における一大分野であり、早い段階から研究対象になっている。
最近[いつ?]の研究では、擬似酵素分析の新しい分野が成長し、進化の間、いくつかの酵素において、アミノ酸配列および異常な﹁擬似触媒﹂特性にしばしば反映されている生物学的触媒を行う能力が失われたことが認識されている[1][2]。
多くの酵素は生体内で作り出されるタンパク質を主成分として構成されている。したがって、生体内での生成や分布の特性、加熱やpHの変化によって変性して活性を失う︵失活︶といった特徴などは、ほかのタンパク質と同様である。
生体を機関に例えると、核酸塩基配列が表すゲノムが設計図に相当するのに対して、生体内における酵素は組立て工具に相当する。酵素はその特徴として、作用する物質︵基質︶をえり好みし︵基質特異性︶、目的の反応だけを進行させること︵反応選択性あるいは反応特異性とも︶によって、生命維持に必要なさまざまな化学変化を起こす。
酵素の人為的な利用として、古来から人類は酵素を用いた発酵による食品・飲料の製造を行ってきた。今日では、酵素の利用は食品製造だけにとどまらず、化学工業製品の製造や日用品の機能向上、医療などの広い分野に応用されている。とりわけ医療分野には、酵素は深く関わっている。たとえば、消化酵素を消化酵素剤として処方したり[3][4]、疾患による酵素量の増減を検査や診断に利用している[5]。また、ほとんどの医薬品は、ターゲットとなる酵素の作用の大小を調節することで効果を発現している。
主な役割[編集]


赤点が酵素、黒線が調節機構を表す。丸く配置された赤点がTCAサイクルである。
生体内での酵素の役割は、生命を構成する有機化合物や無機化合物を取り込み、必要な化学反応を引き起こすことにある。生命現象は多くの代謝経路を含み、それぞれの代謝経路は多段階の化学反応からなっている。
細胞内では、その中で起こるさまざまな化学反応を担当する形で多種多様な酵素が働いている。それぞれの酵素は自分の形に合った特定の原料化合物︵基質︶を外から取り込み、担当する化学反応を触媒し、生成物を外へと放出する。そして再び次の反応のために基質を取り込み、目的の物質を生成し続ける。
ここで放出された生成物は、別の化学反応を担当する酵素の作用を受けて、さらに別の生体物質へと代謝されていく。このような酵素の触媒反応の繰り返しで必要な物質の生成や不必要な物質の分解が進行し、生命活動が維持されていく。
生体内では化学工業のプラントのように基質と生成物の容器が隔てられているわけではなく、さまざまな物質が渾然一体となって存在している。しかし、生命現象を作る代謝経路でいろいろな化合物が無秩序に反応してしまっては生命活動は維持できない。
したがって酵素は、生体内の物質の中から作用するべきものを選び出さなければならない。また、反応で余分なものを作り出してしまうと周囲に悪影響を及ぼしかねないので、ある基質に対して起こす反応は決まっていなければならない。酵素は生体内の化学反応を秩序立てて進めるために、このように高度な基質選択性と反応選択性を持つ。
さらにアロステリズム、阻害などによって化学反応の進行を周りから制御される機構を備えた酵素もある。それらの選択性や制御性を持つことで、酵素は渾然とした細胞内で必要なときに必要な原料を選択し、目的の生成物だけを産生するのである。
このように、細胞よりも小さいスケールで組織的な作用をするのが酵素の役割である。人類が先史時代から利用していた発酵も細胞内外で起こる酵素反応によって行われる。

ヒトの唾液に含まれるアミラーゼ︵リボン図︶。薄黄はカルシウムイオ ン、黄緑は塩化物イオン。

エドゥアルト・ブフナー
ノーベル化学賞

エミール・フィッシャー
最初に発見された酵素はジアスターゼ︵アミラーゼ︶であり、1833年にA・パヤンとJ・F・ペルソ︵Jean Francois Persoz︶によるものである。彼らは麦芽の無細胞抽出液によるでんぷんの糖化を発見し、生命︵細胞︶が存在しなくても、発酵のプロセスの一部が進行することを初めて発見した[6]。酵素の命名法の一部である語尾の﹁-ase﹂はジアスターゼ (diastase)が由来となっている。
また、1836年にはT・シュワンによって、胃液中からタンパク質分解酵素のペプシンが発見・命名されている[7]。このころの酵素は生体から抽出されたまま、実体不明の因子として分離・発見されている。
﹁酵素︵enzyme︶﹂という語は酵母の中︵in yeast︶という意味のギリシア語の "εν ζυμη"︵en zymi︶に由来し、1876年にドイツのウィルヘルム・キューネによって命名された[8][9]。
19世紀当時、ルイ・パスツールによって、生命は自然発生せず、生命がないところでは発酵︵腐敗︶現象が起こらないことが示されていた。したがって﹁有機物は生命の助けを借りなければ作ることができない﹂とする生気説が広く信じられており、酵素作用が生命から切り離すことができる化学反応︵生化学反応︶のひとつにすぎないということは画期的な発見であった。
しかし、酵素は生物から抽出するしか方法がなく、微生物と同様に加熱すると失活する性質を持っていたため、その現象は酵素が引き起こしているのか、それとも目に見えない生命︵細胞︶が混入して引き起こしているのかを区別することは困難であった。
したがって、酵素が生化学反応を起こすという考え方はすぐには受け入れられなかった。当時のヨーロッパの学会では、酵素の存在を否定するパスツールらの生気説派と酵素の存在を認めるユストゥス・フォン・リービッヒらの発酵素説派とに分かれて論争が続いた。
最終的には、1896年にエドゥアルト・ブフナーが酵母の無細胞抽出物を用いてアルコール発酵を達成したことによって生気説は完全に否定され、酵素の存在が認知された[10]。
発見[編集]




鍵と鍵穴説[編集]
上述したように、19世紀後半にはまだ酵素は生物から抽出される実体不明の因子と考えられていたが、酵素の性質に関する研究は進んだ。その研究の早い段階で、酵素の特徴として基質特異性と反応特異性が認識されていた。 これを概念モデルとして集大成したのが、1894年にドイツのエミール・フィッシャーが発表した鍵と鍵穴説である[11]。これは、基質の形状と酵素のある部分の形状が鍵と鍵穴の関係にあり、形の似ていない物質は触媒されない、と酵素の特徴を概念的に表した説である。 現在でも酵素の反応素過程のモデルとして十分に通用する。ただし、フィッシャーはこのモデルの実体が何であるかについては科学的な実証を行っていない。酵素の実体の発見[編集]
1926年にジェームズ・サムナーがナタマメウレアーゼの結晶化に成功し、初めて酵素の実体を発見した[12]。サムナーは自らが発見した酵素ウレアーゼはタンパク質であると実験結果とともに提唱したが、当時サムナーが研究後進国の米国で研究していたこともあり、酵素の実体がタンパク質であるという事実はなかなか認められなかった。 その後、タンパク質からなる酵素の存在がジョン・ノースロップとウェンデル・スタンレーによって証明され、酵素の実体がタンパク質であるということが広く認められるようになった[13]。酵素と分子細胞生物学[編集]
20世紀後半になると、X線回折をはじめとした生体分子の分離・分析技術が向上し、生命現象を分子の構造が引き起す機能として理解する分子生物学と、細胞内の現象を細胞小器官の機能とそれに関係する生体分子の挙動として理解する細胞生物学が成立した。これらの学問によってさらに酵素研究が進展する。すなわち、酵素の機能や性質が、酵素や酵素を形成するタンパク質の構造やそのコンホメーション変化によって説明づけられるようになった。 酵素の機能がタンパク質の構造に起因するものであれば、何らかの酵素に適した構造を持つものは酵素としての機能を発現しうると考えることができる。実際に、1986年にはトーマス・チェックらが、タンパク質以外で初めて酵素作用を示す物質︵リボザイム︶を発見している[14]。 今日においては、この酵素の構造論と機能論に基づいて人工的な触媒作用を持つ超分子︵人工酵素︶を設計し開発する研究も進められている[15][16][17]。特性[編集]
酵素は生体内での代謝経路のそれぞれの生化学反応を担当するために、有機化学で使用されるいわゆる触媒とは異なる基質特異性や反応特異性などの機能上の特性を持つ。
また、酵素はタンパク質をもとに構成されているため、ほかのタンパク質と同様に失活の特性、すなわち熱やpHによって変性し活性を失う特性を持つ。次に酵素に共通の特性である基質特異性、反応特異性、および失活について説明する。
基質特異性[編集]

詳細は「基質特異性」を参照
酵素は作用する物質を選択する能力を持ち、その特性を基質特異性︵英: substrate specificity︶と呼ぶ。
たとえば、あるペプチド分解酵素︵ペプチターゼ︶を作用させてタンパク質を分解する場合は、特定の部位のペプチド結合を加水分解するため、部位によっては基質として認識せずにまったく作用しない。
一方、タンパク質を︵酵素ではなく︶酸・塩基触媒で加水分解する場合は、ペプチド結合の任意の箇所に作用する。また、ペプチド分解酵素はペプチド結合だけに反応し、ほかの結合︵エステルやグリコシド結合︶には作用しないが、酸・塩基触媒ならばペプチド結合もほかの結合も区別することなく分解する。
この特性は酵素研究のごく初期から認識されており、鍵と鍵穴に例えたモデルで説明されていた。20世紀中頃以降、X線結晶解析で酵素分子の立体構造が特定できるようになり、鍵穴の仕組みの手がかりが入手できるようになった。
すなわち、酵素であるタンパク質の立体構造にはさまざまな大きさや形状のくぼみが存在し、それはタンパク質の一次配列︵アミノ酸の配列順序︶に応じて決定されている。前述の鍵穴はまさにタンパク質立体構造のくぼみ︵クラフト︶である。酵素は、くぼみに合った基質だけをくぼみの奥に存在する酵素の活性中心へ導くことで、酵素作用を発現する。
今日では、X線結晶解析によって立体構造を決定しなくても、過去の知見や計算機化学に基づき、タンパク質の一次配列情報やその設計図となる遺伝子の塩基配列情報から立体構造を予測することが可能になりつつある。さらに、生物界に存在しないタンパク質酵素を設計することも、タンパク質以外の物質で同様な手法によって人工酵素を設計することも可能である。
生物界に存在する酵素に適合する基質を研究することで、逆に各種酵素の阻害剤を作ることも可能となる。すなわち、本来の基質よりも強く酵素の活性部位に結合する物質を設計することで、酵素の機能を阻害させる試みである。酵素や阻害剤が設計できるようになったことは、医薬品や分子生物学研究の発展に役立っている。
誘導適合[編集]
詳細は「誘導適合」を参照

酵素と基質が複合体を形成すると、酵素と基質のそれぞれで立体構造の変化が起こる。その際に基質のエントロピーが減少するというモデルがあり、計算科学の手法等からそのエントロピーの変化が検証されている[18]。具体的には、酵素の基質との結合によって、酵素・基質ともに触媒反応により適した分子形状へと変化すると考えられている[19]。酵素との複合化を通じて、基質の立体構造は束縛・規制され︵エントロピーの減少︶、遷移状態に近いものへと変化する。すなわち、反応の活性化エネルギーが低下した状態にあると考えられている。これらの酵素と基質の双方の構造変化によって、誘導的な化学反応が生じるというモデルは誘導適合と呼ばれる。[要検証]。
誘導適合は基質特異性を発現するうえでも重要である。アロステリック効果なども含めて、酵素活性の発現およびその制御において重要な役割を担っているとされる。
反応特異性[編集]
生体内ではある1つの基質に着目しても、作用する酵素が違えば生成物も変わってくる。通常、酵素は1つの化学反応しか触媒しない性質を持ち、これを酵素の反応特異性と呼ぶ。 酵素が反応特異性を持つため、消化酵素などいくつかの例外を除けば、通常1つの酵素は生体内の複雑な代謝経路の1か所だけを担当している。これは、生体を恒常的に維持するための重要な性質である。 まず、ある代謝経路が存在するかどうかは、その代謝経路を担当する固有の酵素が存在するかどうかに左右されるため、その酵素タンパク質を産生する遺伝子の発現によって制御できる。また、代謝産物の1つが過剰になった場合、その代謝経路を担当する固有の酵素の活性にフィードバック阻害が起こるため、過剰な生産が動的に制御される。 酵素はそれぞれに固有の基質と生化学反応を担当するが、同じ生体内でも組織や細胞の種類が異なると、別種の酵素が同じ基質の同じ生化学反応を担当する場合がある。このような関係の酵素を互いにアイソザイム︵英: isozyme︶と呼ぶ。酵素作用の失活[編集]
酵素が役割を果たすとき、またはその活性を失う原因には、酵素を構成するタンパク質の立体構造︵コンホメーション︶が深く関与している。失活の原因となる要因としては、熱、pH、塩濃度、溶媒、ほかの酵素による作用などが知られている。 タンパク質は熱、pH、塩濃度、溶媒など置かれた条件の違いによって容易に立体構造を替えるが、条件が大きく変わると立体構造が不可逆的に大きく変わり、酵素の場合は失活することもある。したがって、酵素反応は至適温度・至適pHや水溶媒など条件が限定される。場合によっては、汚染した微生物が発生するペプチダーゼなどの消化酵素によってタンパク質の構造が失われて失活することもある。 ただし、生物の多様性は非常に広いため、好熱菌、好酸性菌、好アルカリ菌などの持つ酵素︵イクストリーモザイム︶のように極端な温度やpHに耐えうるとされるものや、有機溶媒中でも活性が保たれるものもあり、こうした酵素の工業利用が現実的になり始めている。分類[編集]
酵素の分類方法はいくつかあるが、ここでは酵素の所在による分類と、基質と酵素反応の種類︵基質特異性と反応特異性の違い︶による系統的分類を取り上げる。後者による分類は酵素の命名法と関連している。

膜酵素の模式図。左から埋没型、貫通型、付着型。
生体膜に存在する膜酵素はエネルギー保存や物質輸送に関与するものも多く、生体膜の機能を担う重要な酵素群︵ATPアーゼ、ATP合成酵素、呼吸鎖複合体、バクテリオロドプシンなど︶が多い。生体膜と酵素との位置関係によって3種類に大分できる。
●埋没型 - 生体膜に埋没しているタイプ︵レセプタータンパクなど︶
●貫通型 - 生体膜を貫通しているタイプ︵チャネル、トランスポーター、ATP合成酵素など︶
●付着型 - 生体膜に酵素の一部が付着しているタイプ︵ヒドロゲナーゼなど︶
生体膜は内部が疎水性で外部が親水性であるため︵=脂質二重膜と呼ばれる︶、膜酵素であるタンパク質の部分構造︵側鎖︶の性質も、膜に接しているところは疎水性が強くて膜脂質への親和性がきわめて高く、膜から突出しているところは親水性が強くなっている。
所在による分類[編集]
酵素は生物体内における反応のすべてを起こしているといっても過言ではない。したがって、代謝反応の関与する生物体内であれば普遍的に存在している。酵素は、生体膜︵細胞膜や細胞小器官の膜︶に結合している膜酵素と、細胞質や細胞外に存在する可溶型酵素とに分類される。可溶型酵素のうち、細胞外に分泌される酵素を特に分泌型酵素と呼ぶ。 このような酵素の種類の違いは、酵素以外のタンパク質の種類の違い︵膜タンパク質、分泌型タンパク質︶と同様に、立体構造における疎水性側鎖と親水性側鎖の一次構造上の分布︵タンパク質配列のモチーフ︶の違いによる。ほかのタンパク質と同様に酵素も細胞内のリボゾームで生合成されるが、アミノ酸配列は遺伝子に依存するため、その構造は酵素の進化を反映している。遺伝的に近隣の酵素は類似のモチーフを持ち、酵素群のグループを形成する。膜酵素[編集]

可溶型酵素[編集]
細胞質に存在している酵素は、水に比較的よく溶ける。細胞質での代謝にはこの可溶性酵素が多く関わっている。可溶性酵素は、外部には親水性アミノ酸、内部には疎水性アミノ酸が集まって、球形の立体構造をとっている場合が多い。分泌型酵素[編集]
酵素は細胞内で産生されるが、産生後に細胞外に分泌されるものもあり、分泌型酵素と呼ばれる。消化酵素が代表例であり、細胞外に存在する物質を取り込みやすいように消化するために分泌される。その形状は可溶性酵素と同じく球形をしている場合が多い。 生物に対して何らかの刺激︵熱、pH、圧力などの変化︶を与えると、その刺激に対してエキソサイトーシスと呼ばれる分泌形態で分泌型酵素を放出する現象が見られる場合がある。構造生物学の進歩において、最初に結晶化され立体構造が決定されていった酵素の多くは分泌型酵素であった。系統的分類[編集]
詳細は「EC番号」を参照
酵素を反応特異性と基質特異性の違いによって分類すると、系統的な分類が可能となる。このような系統的分類を表す記号として、EC番号がある。
EC番号は "EC"[注釈 1]に続けた4個の番号 "EC X.X.X.X"︵Xは数字︶によって表し、数字の左から右にかけて分類が細かくなっていく。EC番号では、まず反応特異性を、酸化還元反応、転移反応、加水分解反応、解離反応、異性化反応、ATPの補助を伴う合成、イオンや分子を生体膜を超えての輸送の合計7つのグループに分類している。
●EC 1.X.X.X — 酸化還元酵素
●EC 2.X.X.X — 転移酵素
●EC 3.X.X.X — 加水分解酵素
●EC 4.X.X.X — リアーゼ
●EC 5.X.X.X — 異性化酵素
●EC 6.X.X.X — リガーゼ
●EC 7.X.X.X — ABC輸送体
さらに各グループで分類基準は異なるが、反応特異性と基質特異性との違いとで細分化していく。すべての酵素についてこのEC番号が割り振られており、現在約3,000種類ほどの反応が見つかっている[注釈 2]。
また、ある活性を担う酵素がほかの活性を持つことも多く、ATPアーゼなどはATP加水分解反応のほかにタンパク質の加水分解反応への活性も持っている︵EC番号、酸化還元酵素、転移酵素、加水分解酵素、リアーゼ、異性化酵素、リガーゼなどを参照︶。
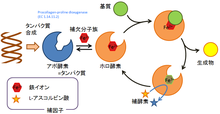
酵素と補因子の関係
RNAを除いて、酵素はタンパク質から構成されるが、タンパク質だけで構成される場合もあれば、非タンパク質性の構成要素︵補因子︶を含む場合︵複合タンパク質︶もある。酵素が複合タンパク質の場合、補因子と結合していないと活性が発現しない。このとき、補因子と結合していないタンパク質をアポ酵素、アポ酵素と補因子とが結合した酵素をホロ酵素という。以下では、特に断らない限り、タンパク質以外の、金属を組み込んでいない有機化合物を単に有機化合物と呼称する。
補因子の例としては、無機イオン、有機化合物︵補酵素︶があり、金属含有有機化合物のこともある。いくつかのビタミンは補酵素であることが知られている[20]。補因子は酵素との結合の強弱で分類されるが、その境界は曖昧である。
また、酵素を構成するタンパク質鎖︵ペプチド鎖︶は複数本であったり、複数種類であったりする場合がある。複数本のペプチド鎖から構成される場合、立体構造を持つそれぞれのペプチド鎖をサブユニットと呼ぶ。
命名法[編集]
酵素の名前は国際生化学連合の酵素委員会によって命名され、同時にEC番号が与えられる。酵素の名称には﹁常用名﹂と﹁系統名﹂が付される。常用名と系統名の違いについて例を挙げながら説明する。 ︵例︶次の酵素は同一の酵素︵EC番号=EC 1.1.1.1︶ ●系統名 — アルコール‥NAD+ オキシドレダクターゼ︵酸化還元酵素︶ 基質分子の名称︵複数の場合は併記︶と反応の名称を連結して命名される。系統名における反応の名称には規制がある。 ●常用名 — アルコールデヒドロゲナーゼ︵脱水素酵素︶ 系統名と同じ規則で命名されるが、基質の一部を省略して短縮されている。また、命名規則に従わない酵素も多く、DNAポリメラーゼなどはそのひとつである。 古くに発見され命名された酵素については、上述の規則ではなく当時の名称がそのまま使用されている。 ペプシン、トリプシン、キモトリプシン、カタラーゼ などがこれにあたる。構成[編集]

補欠分子族[編集]
詳細は「補因子」を参照
|
|
強固な結合や共有結合をしている補因子を補欠分子族︵ほけつぶんしぞく、英: prosthetic group︶という。補欠分子族は有機化合物のこともあるが、酵素から遊離しうる補因子を補欠分子族と区別して、補酵素と呼ぶ。
カタラーゼ、P450などの活性中心に存在するヘム鉄などが代表的な補欠分子族である。金属プロテアーゼの亜鉛イオンなど、直接タンパク質と結合していることもある。生体が要求する微量金属元素は、補欠分子族として酵素に組み込まれていることが多い。
補酵素[編集]
詳細は「補酵素」を参照
有機化合物の補因子を補酵素という。遊離しない場合は補欠分子族という。アポ酵素との結合が弱い、有機化合物の補欠分子族を補酵素とし、補酵素は補欠分子族の一種ととらえる考えもある[24]。とはいえ、たとえば、酵素と共有結合していても遊離しうるリポ酸が補酵素と区別されるなど、補酵素であるか補欠分子族であるかの基準は厳密ではない。
補酵素は、常時酵素の構造に組み込まれていないが、酵素反応が生じる際に基質と共存することが必要とされる。酵素活性のときに取り込まれ、ホロ酵素を生じさせる。したがって、酵素反応の進行によって基質とともに消費され、典型的な補欠分子族とは異なる[25]。
酵素タンパク質が熱によって変性し失活するのに対して、補酵素は比較的耐熱性が高く、かつ透析によって酵素タンパク質から分離することが可能であるため、補因子として早い時期からその存在が知られていた。1931年にはオットー・ワールブルクによって初めて補酵素が発見されている。ビタミンあるいはビタミンの代謝物に補酵素となるものが多い。
NAD、NADP、FMN、FAD、チアミン二リン酸、ピリドキサールリン酸、補酵素A、α-リポ酸、葉酸などが代表的な補酵素であり、サプリメントとして健康食品に利用されるものも多い。
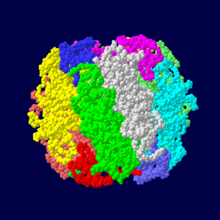
ホウレンソウRubisCOは大サブユニットと小サブユニットのヘテ ロダイマーの8量体で構成される︵サブユニットごとに色分け︶。
酵素が複数のペプチド鎖︵タンパク質鎖︶から構成されることがある。その場合、各ペプチド鎖はそれぞれ固有の三次構造︵立体構造︶をとり、サブユニットと呼ばれる。サブユニット構成を酵素の四次構造と呼ぶこともある。
サブユニットとアイソザイム[編集]

| アイソザイム タイプ |
サブユニット 構成 |
組織分布 |
|---|---|---|
| LD1 | H4 | 心臓 |
| LD2 | H3M | 骨格筋 ・横隔膜 ・腎臓など |
| LD3 | H2M2 | |
| LD4 | HM3 | |
| LD5 | M4 | 肝臓 |
たとえばヒトにおける乳酸デヒドロゲナーゼ︵LDH; E.C. 1.1.1.27︶は4つのサブユニットから構成される四量体だが、体内組織の位置によってサブユニット構成が異なることが知られている。この場合、サブユニットは心筋型︵H[23]︶と骨格筋型︵M[23]︶の2種類であり、そのいずれか4つが組み合わされて乳酸デヒドロゲナーゼが構成される︵たとえばH2個とM2個から構成されるH2M2など︶。したがって5タイプの乳酸デヒドロゲナーゼが存在するが、これらは同じ基質で同じ生化学反応を担当するアイソザイムの関係にある。これを応用すると、たとえば臨床検査で乳酸デヒドロゲナーゼのアイソザイムタイプを同定︵電気泳動で同定できる︶して、疾患が肝炎であるか心筋疾患であるかを識別することができる。
なお、ここに示した以外の要因︵遺伝子変異による一次構造の変化など︶によってアイソザイムとなることもある。

複合酵素の模式図
脂肪酸生成系
一連の代謝過程を担当する複数の酵素がクラスターを形成して複合酵素となることも多い。
代表例として脂肪酸合成系の複合酵素を示す。これらは [ACP]S-アセチルトランスフェラーゼ︵AT; E.C. 2.3.1.38︶、マロニルトランスフェラーゼ︵MT; E,C.2.3.1.39︶、3-オキソアシル-ACPシンターゼI︵KS︶、3-オキソアシル-ACPレダクターゼ︵KR; E.C. 1.1.1.100︶、クロトニル-ACPヒドラターゼ︵DH; E.C. 4.2.1.58︶、エノイル-ACPレダクターゼ︵ER; E.C. 1.3.1.10︶の6種類の酵素がアシルキャリアタンパク質︵ACP︶とともにクラスターとなって複合酵素を形成している。脂肪酸合成系はほとんどが複合酵素で、単独の酵素はアセチルCoAカルボギラーゼ︵TE; E.C. 6.4.1.2︶だけである[21]。
複合酵素[編集]

生化学[編集]
酵素反応速度[編集]
詳細は「酵素反応速度論」を参照
日本工業規格に﹁酵素は選択的な触媒作用をもつタンパク質を主成分とする生体高分子物質﹂︵JIS K 3600:2000-1418[26]︶と定義されているように触媒として利用されるが、化学工業などで用いられる典型的な金属触媒とは反応の特性が異なる。
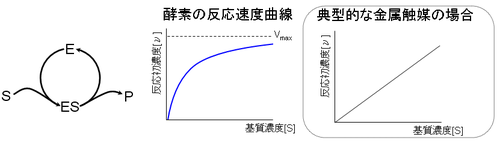 第一に酵素反応の場合、基質濃度[S]が高くなると反応速度が飽和する現象が見られる。酵素の場合、基質濃度を高く変えると、反応速度は飽和最大速度 Vmax へと至る双曲線を描く。一方、金属触媒の場合、反応初速度 [ν] は触媒濃度に依存せず基質濃度 [S] の一次式で決定される。
これは、酵素と金属触媒との粒子状態の違いによって説明できる。金属触媒の場合、触媒粒子の表面は金属原子で覆われており、無数の触媒部位が存在する。それに対して酵素の場合は、酵素分子が基質に比べて巨大な場合が多く、活性中心を多くても数か所程度しか持たない。したがって、金属触媒に比べて、基質と触媒︵酵素︶とが衝突しても︵活性中心に適合し︶反応を起こす頻度が小さい。そして基質濃度が高まると、少ない酵素の活性中心を基質が取り合うようになるため、飽和現象が生じる。このように酵素反応では、酵素と基質が組み合った基質複合体を作る過程が反応速度を決める律速過程になっていると考えられる。
第一に酵素反応の場合、基質濃度[S]が高くなると反応速度が飽和する現象が見られる。酵素の場合、基質濃度を高く変えると、反応速度は飽和最大速度 Vmax へと至る双曲線を描く。一方、金属触媒の場合、反応初速度 [ν] は触媒濃度に依存せず基質濃度 [S] の一次式で決定される。
これは、酵素と金属触媒との粒子状態の違いによって説明できる。金属触媒の場合、触媒粒子の表面は金属原子で覆われており、無数の触媒部位が存在する。それに対して酵素の場合は、酵素分子が基質に比べて巨大な場合が多く、活性中心を多くても数か所程度しか持たない。したがって、金属触媒に比べて、基質と触媒︵酵素︶とが衝突しても︵活性中心に適合し︶反応を起こす頻度が小さい。そして基質濃度が高まると、少ない酵素の活性中心を基質が取り合うようになるため、飽和現象が生じる。このように酵素反応では、酵素と基質が組み合った基質複合体を作る過程が反応速度を決める律速過程になっていると考えられる。
 第一に酵素反応の場合、基質濃度[S]が高くなると反応速度が飽和する現象が見られる。酵素の場合、基質濃度を高く変えると、反応速度は飽和最大速度 Vmax へと至る双曲線を描く。一方、金属触媒の場合、反応初速度 [ν] は触媒濃度に依存せず基質濃度 [S] の一次式で決定される。
これは、酵素と金属触媒との粒子状態の違いによって説明できる。金属触媒の場合、触媒粒子の表面は金属原子で覆われており、無数の触媒部位が存在する。それに対して酵素の場合は、酵素分子が基質に比べて巨大な場合が多く、活性中心を多くても数か所程度しか持たない。したがって、金属触媒に比べて、基質と触媒︵酵素︶とが衝突しても︵活性中心に適合し︶反応を起こす頻度が小さい。そして基質濃度が高まると、少ない酵素の活性中心を基質が取り合うようになるため、飽和現象が生じる。このように酵素反応では、酵素と基質が組み合った基質複合体を作る過程が反応速度を決める律速過程になっていると考えられる。
第一に酵素反応の場合、基質濃度[S]が高くなると反応速度が飽和する現象が見られる。酵素の場合、基質濃度を高く変えると、反応速度は飽和最大速度 Vmax へと至る双曲線を描く。一方、金属触媒の場合、反応初速度 [ν] は触媒濃度に依存せず基質濃度 [S] の一次式で決定される。
これは、酵素と金属触媒との粒子状態の違いによって説明できる。金属触媒の場合、触媒粒子の表面は金属原子で覆われており、無数の触媒部位が存在する。それに対して酵素の場合は、酵素分子が基質に比べて巨大な場合が多く、活性中心を多くても数か所程度しか持たない。したがって、金属触媒に比べて、基質と触媒︵酵素︶とが衝突しても︵活性中心に適合し︶反応を起こす頻度が小さい。そして基質濃度が高まると、少ない酵素の活性中心を基質が取り合うようになるため、飽和現象が生じる。このように酵素反応では、酵素と基質が組み合った基質複合体を作る過程が反応速度を決める律速過程になっていると考えられる。
酵素反応の定式化[編集]
詳細は「酵素反応#酵素反応の定式化」を参照
1913年、L・ミカエリスとM・メンテンは酵素によるショ糖の加水分解反応を測定し、﹁鍵と鍵穴﹂モデルと実験結果から酵素基質複合体モデルを導き出し、酵素反応を定式化した。このモデルによると、酵素は次のように示される。
酵素︵E︶+ 基質︵S︶ 酵素基質複合体︵ES︶→ 酵素︵E︶+ 生成物︵P︶
すなわち、酵素反応は、酵素と基質が一時的に結びついて酵素基質複合体を形成する第1の過程と、酵素基質複合体が酵素と生産物とに分離する第2の過程とに分けられる。
きわめて分子活性の高い酵素に炭酸脱水酵素があるが、この酵素は1秒あたり100万個の二酸化炭素を炭酸イオンに変化させる︵kcat = 106s−1︶。
酵素基質複合体︵ES︶→ 酵素︵E︶+ 生成物︵P︶
すなわち、酵素反応は、酵素と基質が一時的に結びついて酵素基質複合体を形成する第1の過程と、酵素基質複合体が酵素と生産物とに分離する第2の過程とに分けられる。
きわめて分子活性の高い酵素に炭酸脱水酵素があるが、この酵素は1秒あたり100万個の二酸化炭素を炭酸イオンに変化させる︵kcat = 106s−1︶。
 酵素基質複合体︵ES︶→ 酵素︵E︶+ 生成物︵P︶
すなわち、酵素反応は、酵素と基質が一時的に結びついて酵素基質複合体を形成する第1の過程と、酵素基質複合体が酵素と生産物とに分離する第2の過程とに分けられる。
きわめて分子活性の高い酵素に炭酸脱水酵素があるが、この酵素は1秒あたり100万個の二酸化炭素を炭酸イオンに変化させる︵kcat = 106s−1︶。
酵素基質複合体︵ES︶→ 酵素︵E︶+ 生成物︵P︶
すなわち、酵素反応は、酵素と基質が一時的に結びついて酵素基質複合体を形成する第1の過程と、酵素基質複合体が酵素と生産物とに分離する第2の過程とに分けられる。
きわめて分子活性の高い酵素に炭酸脱水酵素があるが、この酵素は1秒あたり100万個の二酸化炭素を炭酸イオンに変化させる︵kcat = 106s−1︶。
阻害様式と酵素反応速度[編集]

詳細は「酵素反応#阻害様式と酵素反応速度」を参照
酵素の反応速度は、基質と構造の似た分子の存在や、後述のアロステリック効果によって影響を受ける︵阻害される︶。阻害作用の種類によって、酵素の反応速度の応答の様式︵阻害様式︶が変わる。そこで、反応速度や反応速度パラメータを解析して阻害様式を調べることで、逆にどのような阻害作用を受けているかを識別することができる。どのような阻害様式であるかを調べることによって、酵素がどのような調節作用を受けているか類推することができる。医薬品開発では、調節作用を研究することは、酵素作用を制御することによって症状を改善する新たな治療薬の開発に応用されている。
阻害様式は大きく分けると次のように分類される。
酵素反応の活性化エネルギー[編集]
| 反応名 | 触媒/酵素† | エネルギー値 (cal/mol[注釈 3] |
|---|---|---|
| H2O2の分解 | (なし) | 18,000 |
| 白金コロイド | 11,000 | |
| カタラーゼ† Catalase; 肝) |
5,000 | |
| ショ糖の加水分解 | H+ | 26,500 |
| サッカラーゼ† (酵母) |
11,500 | |
| カゼイン の加水分解 |
HCl aq. | 20,000 |
| キモトリプシン† (Trypsin) |
12,000 | |
| 酢酸エチルの 加水分解 |
H+ | 13,200 |
| リパーゼ† (Lipase; 膵) |
4,200 |
一般に化学反応の進行する方向は化学ポテンシャルが小さくなる方向︵エネルギーを消費する方向︶に進行し、反応速度は反応の活性化エネルギーが高いか否かに大きく左右される︵化学平衡や反応速度論を参照︶。
酵素反応は触媒反応で、化学反応の一種なので、その性質は同様である。ただし、一般に触媒反応は化学反応の中でも活性化エネルギーが低いのが通常であるが、酵素反応の活性化エネルギーは特に低いものが多い。
一般に活性エネルギーが15,000cal/molから10,000cal/molに低下すると、反応速度定数はおよそ4.5×107倍になる。
反応機構モデル[編集]
詳細は「酵素反応#反応機構モデル」を参照
単純な構造の無機触媒や酸塩基触媒等とは異なり、酵素は基質特異性を発揮し、ターゲットとする反応のみの活性化エネルギーを下げている。こういった、酵素特有の特徴を生み出す酵素反応の機構については、いまだ統一的な見解は得られていない。しかし今日では、構造生物学の発展や組み換えタンパク質等の変異導入といった諸技法によって、その片鱗が明らかにされつつある。
たとえば、タンパク質分解酵素セリンプロテアーゼでは、酵素と複合体を形成することで基質は遷移状態に近い分子構造で束縛され︵反応系のエントロピー減少︶、その結果として活性化エネルギーの低下︵反応の促進︶が起こる︵エントロピー・トラップ︶。[要検証]。

キモトリプシンの酸塩基触媒部位
酵素と結合した基質は、酵素の活性中心付近において分子構造が規制され︵誘導適合︶、より反応しやすい状態となり、生成物への反応が進行する[要検証]。ここでは、セリンプロテアーゼの一種であるキモトリプシンの例を示す。

- His57がプロトンを負に荷電したAsp102に譲渡する。
- His57が塩基となり、活性中心のSer195からプロトンを奪う。
- Ser195が活性化されて(負に荷電して)基質を攻撃する。
- His57がプロトンを基質に譲渡する
- Asp102からHis57がプロトンを奪い、1.の状態に戻る。
遷移状態と抗体酵素[編集]
詳細は「酵素反応#遷移状態と抗体酵素」を参照
酵素反応において、酵素基質複合体から生成物へと変化する過程では、原子間の結合距離や角度などが変形した分子構造となる遷移状態や反応中間体を経由する。
言い換えると、化学反応がしやすい分子の形状が遷移状態であり、酵素は酵素基質複合体が誘導適合することでその状態を作り出している。遷移状態は活性ポテンシャルの高い状態に相当するため、少ないエネルギーで反応中間体の状態を乗り越えて生成物へと変化する。
遷移状態を作ることが酵素タンパクの主たる役割だとすれば、結合によって遷移状態を作り出すことができれば酵素になるとも考えられる。実際に酵素と同じように分子構造を識別し、その分子と結合する生体物質に抗体がある。1986年、アメリカのトラモンタノらは、酵素と同じ働きをするように意図して製造した抗体が意図どおりの酵素作用を示すことを発見し、抗体酵素︵abzyme︶と名づけた。
超分子化合物によって、人工酵素を作り出す研究も成果を上げている。
酵素反応の調節機構[編集]
詳細は「酵素反応#酵素反応の調節機構」を参照
生体が酵素活性の大小を制御するには、酵素の量を制御する場合と、酵素の性質を変化させる場合とがある。それらは次のように分類される[28]。
(一)酵素タンパク質の合成量制御による酵素量の増大
(二)酵素タンパク質が他の生体分子と可逆的に作用することによる酵素活性の変化
(三)酵素タンパク質が修飾されることによる酵素活性の変化
1.の調整は遺伝子の発現量の転写調節によって実現し、2.や3.については酵素の質的な変化であり、1.の転写制御より素早い応答を示す。
2.や3.の調節の例として﹁フィードバック阻害﹂が挙げられる。フィードバック阻害によって生産物が過剰になると酵素活性が低減し、生産物が減ると酵素活性は復元する。
酵素が働く条件[編集]
大きく次の4つに分けられる。
(一)最適pH
(二)最適温度
(三)基質の濃度
(四)酵素の濃度
最適pH[編集]
各酵素にはもっとも活発に機能するpHがあり、これを最適pH︵英: optimal pH︶、もしくは至適pHという。ほとんどの酵素は各環境の生理的pHで活動がもっとも激しくなる。たとえばヒトの体内では通常最適pHは7付近であるが、胃液の中に含まれるペプシンの最適pHは1.5、トリプシンの最適pHは約8、アルギナーゼ︵en:Arginase︶の最適pHは9.5である。最適pHが酵素をもっとも安定化させるpHではないことに注意が必要である。最適温度[編集]
最適pHと同様に、酵素の活動がもっとも激しくなる温度が存在する。これを最適温度︵optimal temperature︶、もしくは至適温度ともいう。ヒトの酵素の場合、通常は生理的温度である35℃から40℃付近とされる。最適pHと同様に、最適温度が酵素をもっとも安定化させる温度ではないことに注意が必要である。基質の濃度[編集]
詳細は「酵素反応速度論」を参照
酵素の機能は基質の濃度に依存する。基本的には、基質の濃度が上がるほど反応速度が上がるが、ある一定の濃度で飽和を迎える。さらに基質の濃度を増やすことで、逆に酵素の機能が著しく阻害されることもある。これら酵素と基質濃度の関係は、酵素や基質の種類によってさまざまである。
酵素の濃度[編集]
詳細は「酵素反応速度論」を参照
酵素の機能は酵素自体の濃度にも依存する。基本的には、酵素の濃度が上がるほど反応速度が上昇する。生体内での酵素濃度は、遺伝子の発現によって制御される。In vitroでは、酵素の溶解度に依存するが、濃度を高めすぎた結果沈殿した酵素は構造が破壊されている場合がほとんどであり、再び溶解させても機能を回復させることは難しい。

チーズの製造にはレンネットが利用される
人間は有史以前から、保存食などを作り出すために発酵を利用してきた。たとえば、味噌や醤油、酒などの発酵食品の製造には、伝統的に麹や麦芽などの生物を利用してきた。
蒸米や蒸麦に種麹を与え、40時間ほどおくと麹菌が増殖し、米麹や麦麹となるが、こうした麹には各種の酵素、プロテアーゼ、アミラーゼ、リパーゼなどが蓄積される[29]。発酵とは、これらの酵素が食品中のタンパク質をペプチドやアミノ酸へと分解して旨味となり、炭水化物を乳酸菌や酵母が利用できる糖へと分解し甘味となり、独特の風味となっていく[29]。
今日では、酵素の実体や機能の詳細が判明したため、発酵食品であっても生物を使わずに酵素自体を作用させて製造することもあり、酵素を使って食品の性質を意図したように変化させることが可能になっている。
酵素反応は、一般に流通している加工食品の多くにおいて製造工程中に利用されているほか、でん粉を原料とした各種糖類の製造にも用いられている。また、果汁の清澄化や苦味除去、肉の軟化といった品質改良や、リゾチームによる日持ち向上などにも用いられている。最初に発見された酵素であるジアスターゼはアミラーゼの一種であり、消化剤として用いられる。
利用[編集]
酵素は実生活のさまざまな場面で応用されている。1つは酵素自体を利用するもので、代表的な分野として食品加工業が挙げられる。もう1つは生体が持つ酵素を観測・制御するもので、代表的な分野として医療・製薬業が挙げられる。食品[編集]

| 目的 | たんぱく質を 分解 |
でんぷん類を 分解 |
セルロース、 木質を分解 |
成分を変換 | その他 |
| 酵素名 | プロテアーゼ類 | アミラーゼ類 | セルラーゼ類 | イソメラーゼ類 | |
|---|---|---|---|---|---|
| 化粧品・日用品 | アルカリプロテアーゼ セリンプロテアーゼ |
デキストラナーゼ | |||
| 食品工業 | グルタミナーゼ | α-アミラーゼ β-アミラーゼ アミロプルラナーゼ グルコアミラーゼ |
ヘミセルラーゼ アラバナーゼ |
イソメラーゼ全般 グルコースイソメラーゼ(転化糖) |
|
| 醸造工業 | プロテアーゼ全般 | α-アミラーゼ β-グルカナーゼ |
セルラーゼ全般 ヘミセルラーゼ |
||
| 飼料用 | α-アミラーゼ | セルラーゼ全般 ヘミセルラーゼ ペクチナーゼ フィターゼ |
|||
| 洗剤用 繊維加工用 |
アルカリプロテアーゼ | アミロプルラナーゼ | セルラーゼ全般 プロトペクチナーゼ ペクチナーゼ |
リパーゼ (油分分解) ペルオキシダーゼ (漂白) | |
| 紙・パルプ関連 | キシラナーゼ | リパーゼ (エステル交換) |
以下に挙げるような分野で酵素が使われている。
●糖類の製造
●α-アミラーゼ - 水あめの製造
●β-アミラーゼ - 麦芽糖の製造
●グルコースイソメラーゼ - 異性化糖︵果糖︶の製造
●グルコアミラーゼ - ブドウ糖の製造
●トレハロース生成酵素とトレハロース遊離酵素 - トレハロースの製造
●食肉・乳製品加工
●パパイン - 食肉の軟化
●レンネット - チーズの製造
●食品の改質
●グルタミナーゼ - L-グルタミン酸への変換による味質向上
●ペクチナーゼ - 果汁・果実酒の清澄化
●ヘミセルラーゼ - パンの改質
︵澱粉とグルテンの相互作用によるパンの老化を低減する︶
●卵白リゾチーム - 保存性の向上
これらの酵素は生物由来の天然物とされるため、食品関連法規で求められる原材料表示では省略されていることが多い。また、発酵食品を除く加工食品では、酵素は加工助剤として利用するため、製造工程中に失活または除去されて、完成した食品中には存在しない。したがって、これらの酵素は食品添加物とは異なる扱いになっている。
健康効果を標榜する製品[編集]
キモトリプシンとトリプシン︵牛︶、パンクレアチンは牛や豚の膵臓から、パンクレリパーゼ︵豚︶は医薬品として、ブロメライン︵パイナップル︶やパパイン︵パパイヤ︶はタンパク質消化を助ける健康食品としてよく用いられる[30]。酵素を含む消化酵素剤が、第2類医薬品や医薬部外品として販売されている。高峰譲吉が小麦の皮フスマから発酵培養させたデンプン分解酵素のタカヂアスターゼも、配合される酵素のひとつである[31]。消化酵素剤が病院で処方されることもあり、体内の消化酵素不足による消化器症状や血流、皮膚症状を起こしている状態を改善することが目的である[32]。また消化酵素剤は膵臓の病気による酵素不足のために医療として用いられ有効である[3][4]。「消化酵素」も参照
日本では傷の壊死組織を除去するためのブロメラインの軟膏の医薬品がある。日本国外では同じ目的でパパインの軟膏が利用できる国もあり、健康な皮膚組織には影響を与えにくい[33]。パパインが含まれるパックや洗顔料も市販されている。
日用品[編集]
今日では、洗剤や化粧品などの日用品に高い付加価値をつけるために酵素が利用される場合が多い。
たとえば洗濯の場合、汗しみや食べ物しみは石鹸だけでは落としにくい。単純な油しみと違って固形物であるタンパク質を含んでおり、しみ成分が固形分と絡まって衣類の繊維に強く接着しているため、界面活性剤だけで洗濯しても汚れを落としきれない。そこで、タンパク質を分解する酵素であるプロテアーゼを含んだ酵素入り洗剤が広く利用されている。
ただし、通常のプロテアーゼは石鹸が溶けたアルカリ性領域では作用しないため、アルカリ性領域で良好に作用する︵至適pHを持つ︶アルカリプロテアーゼが利用されている。
アルカリプロテアーゼは、1947年にオッテセン︵M. Ottesen︶らが好アルカリ菌から発見した。今日ではアルカリプロテアーゼは酵素入り洗剤用に大量生産されており、工業製品として生産されるプロテアーゼの60%以上を占めるようになっている[21]。

パパイヤから得るパパイン︵リボン図︶
プロテアーゼ以外には、衣類のセルロース繊維を部分的に分解して汚れが拡散しやすいようにするために、セルラーゼを添加している洗剤もある。
同じような例として、食器の洗剤に酵素であるプロテアーゼ︵タンパク質汚れ︶やリパーゼ︵油汚れ︶を添加することで汚れ落ちを増強したり、アミラーゼ︵澱粉質の糊︶を添加することで流水だけで洗浄する自動食器洗浄機でも汚れが落ちるように工夫したりしている例が挙げられる。なお、洗剤用酵素の安全性はよく調べられており、環境中で容易かつ究極的に分解する[34]。
化粧品への酵素の応用例としては、脱毛剤にケラチンを分解する酵素パパイン︵プロテアーゼの一種︶を添加することで、皮膚から突出したむだ毛を分解切断する例などがある。
歯磨きへの酵素の応用例として、歯垢に含まれるデキストランを分解する酵素デキストラナーゼを添加している製品がある。

医療[編集]
20世紀に入って増大した酵素に対する知見は、医療や治療薬に劇的な改革をもたらした。ヒトの体内で生じている代謝には酵素が関与しているため、酵素の存在量を測定する臨床検査によって疾病を診断することが可能になっている︵サブユニットとアイソザイム節の乳酸デヒドロゲナーゼの例を参照︶。
また酵素による調節︿ホメオスタシス﹀の失調が病気の原因である場合は、酵素活性を抑制する治療薬によって症状を治療することができる︵例‥高血圧におけるアンジオテンシン変換酵素阻害薬、糖尿病におけるインクレチン分解酵素を阻害するDPP4阻害薬など︶。
逆に、酵素が欠損する先天性の代謝異常疾患が知られているが、発病前に酵素の量を検査して、発症を抑える治療を行うことができる︿記事 遺伝子疾患に詳しい﹀︵例‥ゴーシェ病︶。

バイオリアクター装置︵小型︶
製品には含まれなくても、食品工業から香料・医薬品原料などファインケミカルの分野まで多方面の食品原料や化成品の製造に酵素が利用されている。
たとえば、生体から抽出された酵素を工業化学で利用する際の技術として、酵素の固定化が一般化している。固定化とは、工業用酵素を土台となる物質︵担体︶に固定して用いる方法である。経済的に生産するためには、逆反応が起こらないように反応系から生成物を効率よく除去する必要がある。しかし、このとき同時に酵素も除去してしまうと、本来は再生・再利用可能な触媒である酵素も使い捨てになってしまう。固定化は、この問題を解決する方法である。
今日では、固定化酵素は、バイオリアクター技術として食品工業から香料・医薬品原料などファインケミカルの分野まで多方面の化成品の製造に利用されている。バイオリアクターは、ポンプで基質︵原料︶を注入すると同時に生成物を流出させる生産装置であり、酵素を担体とともに柱状の反応装置内に固定することによって、酵素のリサイクルの問題や連続生産による経済性の向上などの問題点を解決している。バイオリアクター用の酵素あるいは酵素を含む微生物の固定化には、紅藻類から単離される多糖類のκ-カラギーナン︵食品・化粧品のゲル化剤にも利用される︶が汎用される。
世界で初めて固定化酵素を使った工業化に成功したのは千畑一郎、土佐哲也らであり、1967年に DEAE-Sepadex担体に固定化したアミノアシラーゼ︵E.C. 3.5.1.14︶を使って、ラセミ体であるN-アシル-DL-アミノ酸の混合物から目的のL-アミノ酸だけを不斉加水分解して光学活性なアミノ酸を得る方法を開発した[21]。
工業利用の技術︵固定化酵素︶[編集]

バイオセンサー[編集]
詳細は「バイオセンサー」を参照
酵素の基質特異性と反応性を利用して化学物質を検出するセンサーが実用化されている。これらは生体由来の機能を利用することからバイオセンサーと呼ばれ、1960年代に研究が始まり1976年にアメリカでグルコースセンサーが市販されて以来、医療診断や環境測定などの場面で用いられてきた[35]。酵素を用いるバイオセンサーは特に酵素センサーと呼ばれる。
電気化学と酵素の化学が組み合わせられたグルコースセンサーでは、電極の上にグルコースオキシダーゼが固定化されている。検体中にグルコースが存在してグルコースオキシダーゼが作用すると酸化還元反応によって電極に電流が流れ、グルコースを定量することができる。糖尿病患者が自身の血糖値を調べるために用いる市販の血糖値測定器では、このグルコースセンサーが利用されている。
このほか、蛍光発光、水晶振動子、表面プラズモン共鳴などの原理と酵素とを組み合わせたバイオセンサーが研究されている。
生命の起源と酵素[編集]
「生命の起源」も参照
現存するすべての生物種において、酵素を含むすべてのタンパク質の設計図はDNA上の遺伝情報であるゲノムに基づいている。一方、DNA自身の複製や合成にも酵素を必要としている。つまり、酵素の存在はDNAの存在が前提であり、一方でDNAの存在は酵素の存在が前提であるから、ゲノムの起源においてDNAの確立が先か酵素の確立が先かというパラドックスが存在していた。最近の研究では、このパラドックスについて、いまだ確証はないものの以下のように説明している。

リボザイムの作用機序。リボザイムは配列を認識してmRNAを特定部 位で切断する。
1986年にアメリカのトーマス・チェックらによって発見されたリボザイムは、触媒作用を持つRNAであり、次の3種類の反応を触媒することが知られている[36]。
(一)自分自身に作用してRNAを切断する。︵グループ I, II, III イントロンの自己スプライシング︶
(二)他の RNA に作用してRNAを切断する。︵リボヌクレアーゼP︶
(三)ペプチド結合の形成。︵リボゾーム23S rRNA︶
特性1.および2.からは、RNAは自己複製していた段階の存在があるとも考えられる。また、特性3.からは、RNAが酵素の役割も担う場合があることがわかる。このことから、仮説ではあるが、現在のゲノムの発現機構︵セントラルドグマと言い表される︶が確立する前段階において、遺伝子と酵素との役割を同じRNAが担っているRNAワールドという段階が存在したと考えられている。
なお、特性3.の例として挙げた23S rRNAは、大腸菌のタンパク質を合成するリボゾーム内に存在する。大腸菌のリボゾームにおいては、アミノアシルtRNAから合成されるペプチドにアミノ酸を転位・結合させる酵素の活性中心の主役が、タンパク質ではなく23S rRNAとなっている[37]。さらに、この場合の酵素作用︵ペプチジルトランスフェラーゼ活性︶は、23S rRNAのドメインVに依存することも判明している[38]。
また、リボザイムが自己切断する際には鉛イオンが関与する例が判明している。このことから、RNAもタンパク質酵素の補因子と共通の仕組みを持っているという可能性が示唆されている[39]。
RNAワールド説によると、ゲノムを保持する役割はDNAへ、酵素機能はタンパク質へと淘汰が進んで、RNAワールドが今日のセントラルドグマへと進化したと考えられている。その段階では、次のようなRNAの特性が進化の要因として寄与したと推定されている[40]。
遺伝子の保管庫がDNAではなくRNAであったと仮定した場合、RNAには不利な特性がある。それは、リボース2'位の水酸基が存在するため、エステル交換によって環状ヌクレオシド︵環状AMPなど︶を形成してヌクレオチドが切断されやすいという性質である。これに対してDNAは、リボース2'位の水酸基を欠くため環状リン酸エステルを形成せず、RNAの場合より安定なヌクレオチドを形成する。
また、立体構造の多様性について考察すると、RNAの立体構造はタンパク質に比べて高次構造が単純になることが判明している。したがって、RNAから構成される酵素に比べ、タンパク質から構成される酵素の方が立体構造の多様性が大きく、基質特異性の面や遷移状態モデルを形成する上でより性能のよい酵素になると考えられる[41]。

人工酵素[編集]
分子構造が分子認識と遷移状態の形成に関与していることが判明して以来、酵素の構造を変化させることで人工的な酵素︵人工酵素︶を作り出す試みがなされている。そのアプローチ方法としては
(一)酵素タンパク質の設計を変える方法
(二)超分子化合物を設計する方法
が挙げられる。
前者は1980年代ごろから試みられており、アミノ酸配列を変異させて酵素の特性がどのように変化するのか、試行錯誤的に研究がなされた。異種の生物間でゲノムを比較できるようになり、異なる生物に由来する同一酵素について共通性の高い部分とそうでない部分とが明確になったため、それを踏まえて配列を変化させるのである︵いわゆるバイオテクノロジー技術の一環︶。1990年代以降にはコンピュータの大幅な速度向上とデータの大容量化が進行し、実際のタンパク質を測定することなく、コンピュータシミュレーションによって一次配列からタンパク質の立体構造を設計し、物性を予測することができつつある。また、2000年代に入るとゲノムの完全解読がさまざまな生物種で完了し、遺伝子情報から分子生物学上の問題を解決しようとする試み︵バイオインフォマティクス技術︶がなされている。そして現在、バイオインフォマティクス情報からタンパク質機能を解明するプロテオミックス技術へと応用が展開されつつある。2008年には、計算科学的な手法によって設計された、実際にケンプ脱離の触媒として機能する酵素が報告されている[42]。
後者の超分子化合物を設計する方法については、1980年代ごろから、分子認識を行う超分子化合物︵すなわち基質特異性をモデル化した化合物︶の研究が開始された。当初は基質構造の細部までは認識できなかったため、分子の嵩高さを識別することから始められた。ただし早い時期から、ほかの分子と静電相互作用で結合する包摂化合物︵シクロデキストリンやクラウンエーテルなど︶は知られていた。そこで最初の人工酵素として、リング状の構造を持つシクロデキストリンに活性中心を模倣した側鎖構造を修飾することによって、中心空洞にはまり込む化合物に対してだけ反応する化学物質が設計された。今日では分子を認識すると蛍光を発するような超分子化合物も設計されている。
また、活性中心で生じている遷移状態を作り出す方法論は反応場理論として体系付けられている。反応場理論の1つの応用が、2001年にノーベル化学賞を受賞した野依良治やバリー・シャープレスらの不斉触媒として成果を挙げている。
代表的な酵素の一覧[編集]
分類については「EC番号」を、酵素記事の総覧については「Category:酵素」を参照
代表的な酵素の一覧を示す。
(一)消化・同化作用・異化作用・エネルギー代謝に関与する酵素
●プロテアーゼ︵タンパク質分解酵素︶
●ペプシン、トリプシン – タンパク質消化酵素
●パパイン、ブロメライン – 食物由来の消化酵素
●トロンビン – 血液凝固系の酵素
●脂質分解酵素
●リパーゼ – 中性脂肪の消化
●リポ蛋白質リパーゼ – 体内脂質輸送
●酸化酵素︵オキシゲナーゼ︶
●モノオキシゲナーゼ
●シトクロムP450 – 薬物分解酵素
●ペルオキシダーゼ
●カタラーゼ – 過酸化水素︿活性酸素の生成物のひとつ﹀の分解
●エネルギー代謝に関する酵素
●ATP合成酵素 – 呼吸鎖複合体におけるATP産生
●リブロース1,5-ビスリン酸カルボキシラーゼ/オキシゲナーゼ︿RubisCO﹀– 炭酸固定︿光合成﹀
(二)遺伝に関与する酵素
●DNAポリメラーゼ – DNAの複製・修復
●RNAポリメラーゼ – m-RNAへの転写、遺伝子の発現
●ヌクレアーゼ– DNA・m-RNAの編集、核酸代謝
●制限酵素 – 遺伝子工学。
●アミノアシルtRNAシンセテース – t-RNAの合成
(三)細胞内のシグナル伝達・分子修飾に関与する酵素
●リン酸化酵素︵キナーゼ︶– シグナル化
●脱リン酸化酵素︵フォスファターゼ︶– 脱シグナル化
●グリコシルトランスフェラーゼ – 糖鎖の修飾
●DNAメチラーゼ – 遺伝子発現の制御
酵素に関する年表[編集]
「生化学の歴史#酵素」も参照
●19世紀
●1833年 フランスのアンセルム・パヤンとジャン・フランソワ・ペルソは、麦芽の抽出液からデンプンを分解して単糖︵グルコース︶にする物質を分離した。彼らはこの物質を﹁ジアスターゼ﹂︵現在、フランス語で﹁酵素﹂を意味する︶と名づけた。
●1836年 ドイツのテオドール・シュワンは胃液が動物の肉を溶かす作用があることを発見し、胃液から原因物質を分離した。この物質は﹁ペプシン﹂と名づけられた。これは植物だけでなく動物にも同様の活性が存在することを証明したものである。
●1857年 フランスのルイ・パスツールがアルコール発酵過程が微生物︵当時は酵母の研究︶活動に基づくものであると発表した。ただし、これは酵素という無生物が起こすものとはパスツールは証明しなかった。しかし、ドイツのユストゥス・フォン・リービッヒは微生物ではなく、細胞外の無生物因子︵当時は﹁発酵素︵fermente︶﹂という用語を用いた︶が発酵に関与しているとして、この説を否定した。
●1873年 スウェーデンのイェンス・ベルセリウスが﹁化学反応は触媒作用によって進行する﹂という概念を提唱した︵この概念は酵素の概念が認められたためである︶。
●1878年 ドイツのウィルヘルム・キューネが酵母︵ギリシャ語で "zyme"︶の内部︵ギリシャ語で"en"︶で発酵が起きることを受けて﹁酵素︵en-zyme︶﹂という概念を提唱。
●1894年 ドイツのエミール・フィッシャーが酵素の基質特異性を説明するために、酵素と基質の﹁鍵と鍵穴説﹂を発表した。
●1894年 日本の高峰譲吉がタカジアスターゼを発見した。
●1897年 ドイツのエドゥアルト・ブフナーが、酵母抽出液からアルコール発酵が起きることを証明した。
●20世紀
●1902年 イギリスのフェルディナント・ブラウンとフランスのアンリ・ルシャトリエは、スクラーゼの活性は酵素濃度に規定されることを観察し、反応の最中に基質と酵素は酵素基質複合体を作るという考えに至った︵反応速度論の始まり︶。
●1907年 エドゥアルト・ブフナーが前述の功績を受けてノーベル化学賞を受賞。 ●1913年 ミカエリス、メンテンらがブラウンとルシャトリエの結果を受けて﹁ミカエリス・メンテン式﹂を発表。
●1925年 G・E・ブリッグスとJ・B・S・ホールデンがミカエリス・メンテン式を発展させた﹁ブリッグス・ホールデンの速度論﹂を発表。
●1926年 アメリカのジェームズ・サムナーがナタ豆から﹁ウレアーゼ﹂と呼ばれる酵素を結晶化して、酵素の本体がタンパク質であることを突き止めた︵ただしこの実験は当時評価されなかった︶。
●1930年 アメリカのジョン・ノースロップがペプシン、トリプシン、キモトリプシンをタンパク質の結晶として抽出した。
●1931年 ドイツのオットー・ワールブルクが、呼吸酵素の特性および作用機構の発見によってノーベル生理学・医学賞を受賞。
●1913年 ミカエリス、メンテンらがブラウンとルシャトリエの結果を受けて﹁ミカエリス・メンテン式﹂を発表。
●1925年 G・E・ブリッグスとJ・B・S・ホールデンがミカエリス・メンテン式を発展させた﹁ブリッグス・ホールデンの速度論﹂を発表。
●1926年 アメリカのジェームズ・サムナーがナタ豆から﹁ウレアーゼ﹂と呼ばれる酵素を結晶化して、酵素の本体がタンパク質であることを突き止めた︵ただしこの実験は当時評価されなかった︶。
●1930年 アメリカのジョン・ノースロップがペプシン、トリプシン、キモトリプシンをタンパク質の結晶として抽出した。
●1931年 ドイツのオットー・ワールブルクが、呼吸酵素の特性および作用機構の発見によってノーベル生理学・医学賞を受賞。 ●1945年 アメリカのジョージ・ウェルズ・ビードルとエドワード・ローリー・タータムは1つの遺伝子が1つの酵素に対応することを発表した︵一遺伝子一酵素説︶。
●1946年 サムナーとノースロップは酵素の本体がタンパク質であることを証明し、ノーベル化学賞を受賞した。
●1945年 アメリカのジョージ・ウェルズ・ビードルとエドワード・ローリー・タータムは1つの遺伝子が1つの酵素に対応することを発表した︵一遺伝子一酵素説︶。
●1946年 サムナーとノースロップは酵素の本体がタンパク質であることを証明し、ノーベル化学賞を受賞した。 ●1955年 サンガーらはインスリンの一次構造を決定した。
●1955年 スウェーデンのヒューゴ・テオレルが、酸化酵素の研究によってノーベル生理学・医学賞を受賞。
●1955年 サンガーらはインスリンの一次構造を決定した。
●1955年 スウェーデンのヒューゴ・テオレルが、酸化酵素の研究によってノーベル生理学・医学賞を受賞。 ●1960年 アメリカのウィリアム・スタインとスタンフォード・ムーアによって、リボヌクレアーゼのアミノ酸配列が決定された。
●1962年 ジョン・ケンドリューとマックス・ペルーツが、球状タンパク質の構造研究によってノーベル化学賞を受賞。
●1960年 アメリカのウィリアム・スタインとスタンフォード・ムーアによって、リボヌクレアーゼのアミノ酸配列が決定された。
●1962年 ジョン・ケンドリューとマックス・ペルーツが、球状タンパク質の構造研究によってノーベル化学賞を受賞。 ●1965年 イギリスのデビッド・フィリップスはリゾチームと基質の複合体の立体構造を明らかにした︵酵素として立体構造が決定されたのはこれが初めて︶。
●1965年 フランスのフランソワ・ジャコブ、アンドレ・ルウォフ、ジャック・モノーが、酵素およびウイルスの合成の遺伝的調節に関する研究によってノーベル生理学・医学賞を受賞。
●1965年 イギリスのデビッド・フィリップスはリゾチームと基質の複合体の立体構造を明らかにした︵酵素として立体構造が決定されたのはこれが初めて︶。
●1965年 フランスのフランソワ・ジャコブ、アンドレ・ルウォフ、ジャック・モノーが、酵素およびウイルスの合成の遺伝的調節に関する研究によってノーベル生理学・医学賞を受賞。 ●1965年 高崎義幸らが、グルコースイソメラーゼを用いて異性化糖の製造法を発明。
●1968年 H.O.Smith, K.W.ウィルコックスらがDNAの制限酵素を発見した。
●1968年アメリカのジョー・マッコード、アーウィン・フリドビッチがフリーラジカルを排除する酵素、スーパーオキシドジスムターゼ︵SOD︶を発見。
●1969年 アメリカのロバート・メリフィールドが、ペプチド固相合成法を用いて、化学的にリポヌクレアーゼを合成した。
●1972年 スタインとムーアは酵素の一次構造決定によってノーベル化学賞を受賞。
●1965年 高崎義幸らが、グルコースイソメラーゼを用いて異性化糖の製造法を発明。
●1968年 H.O.Smith, K.W.ウィルコックスらがDNAの制限酵素を発見した。
●1968年アメリカのジョー・マッコード、アーウィン・フリドビッチがフリーラジカルを排除する酵素、スーパーオキシドジスムターゼ︵SOD︶を発見。
●1969年 アメリカのロバート・メリフィールドが、ペプチド固相合成法を用いて、化学的にリポヌクレアーゼを合成した。
●1972年 スタインとムーアは酵素の一次構造決定によってノーベル化学賞を受賞。 ●1975年 オーストラリアのジョン・コーンフォースが、酵素による触媒反応の立体化学的研究によってノーベル化学賞を受賞。
●1975年 オーストラリアのジョン・コーンフォースが、酵素による触媒反応の立体化学的研究によってノーベル化学賞を受賞。 ●1978年、アメリカのダニエル・ネーサンズ、ハミルトン・スミス、スイスのヴェルナー・アーバーが制限酵素の発見と分子遺伝学への応用によってノーベル生理学・医学賞を受賞。
●1978年、アメリカのダニエル・ネーサンズ、ハミルトン・スミス、スイスのヴェルナー・アーバーが制限酵素の発見と分子遺伝学への応用によってノーベル生理学・医学賞を受賞。 ●1986年 アメリカのトーマス・チェックらによって触媒作用を有するRNAである﹁リボザイム﹂が発見された。これによって、触媒作用はタンパク質に依らないという概念ができた。さらに生命の起源はRNAから始まったとする﹁RNAワールド仮説﹂の元になっている。
●1986年 アメリカのトラモンタノらは抗体酵素︵abzyme︶を発見した。
●1989年 チェックらはリボザイムの発見によってノーベル化学賞を受賞した。
●1986年 アメリカのトーマス・チェックらによって触媒作用を有するRNAである﹁リボザイム﹂が発見された。これによって、触媒作用はタンパク質に依らないという概念ができた。さらに生命の起源はRNAから始まったとする﹁RNAワールド仮説﹂の元になっている。
●1986年 アメリカのトラモンタノらは抗体酵素︵abzyme︶を発見した。
●1989年 チェックらはリボザイムの発見によってノーベル化学賞を受賞した。 ●1992年 スイスのエドモンド・フィッシャー、アメリカのエドヴィン・クレープスが生体制御機構としての可逆的タンパク質リン酸化の発見によって︵タンパク質キナーゼ︶ ノーベル生理学・医学賞を受賞。
●1992年 スイスのエドモンド・フィッシャー、アメリカのエドヴィン・クレープスが生体制御機構としての可逆的タンパク質リン酸化の発見によって︵タンパク質キナーゼ︶ ノーベル生理学・医学賞を受賞。 ●1997年 アメリカのポール・ボイヤー、イギリスのジョン・E・ウォーカーが、アデノシン三リン酸︵ATP︶の合成の基礎となる酵素機構の解明によって︵ATPシンターゼ︶、デンマークのイェンス・スコウがイオン輸送酵素、Na+、K+-ATPアーゼの最初の発見によってノーベル化学賞を受賞。
●1997年 アメリカのポール・ボイヤー、イギリスのジョン・E・ウォーカーが、アデノシン三リン酸︵ATP︶の合成の基礎となる酵素機構の解明によって︵ATPシンターゼ︶、デンマークのイェンス・スコウがイオン輸送酵素、Na+、K+-ATPアーゼの最初の発見によってノーベル化学賞を受賞。 ●21世紀
●2009年 アメリカのエリザベス・H・ブラックバーン、キャロル・W・グライダー、ジャック・W・ショスタクがテロメアとテロメラーゼ酵素の仕組みの発見によってノーベル生理学・医学賞を受賞。
●21世紀
●2009年 アメリカのエリザベス・H・ブラックバーン、キャロル・W・グライダー、ジャック・W・ショスタクがテロメアとテロメラーゼ酵素の仕組みの発見によってノーベル生理学・医学賞を受賞。 ●2018年 アメリカのフランシス・アーノルドが指向性進化により人工的に酵素を合成する手法を開発し、2018年にノーベル化学賞を受賞した。
●2018年 アメリカのフランシス・アーノルドが指向性進化により人工的に酵素を合成する手法を開発し、2018年にノーベル化学賞を受賞した。
 ●1913年 ミカエリス、メンテンらがブラウンとルシャトリエの結果を受けて﹁ミカエリス・メンテン式﹂を発表。
●1925年 G・E・ブリッグスとJ・B・S・ホールデンがミカエリス・メンテン式を発展させた﹁ブリッグス・ホールデンの速度論﹂を発表。
●1926年 アメリカのジェームズ・サムナーがナタ豆から﹁ウレアーゼ﹂と呼ばれる酵素を結晶化して、酵素の本体がタンパク質であることを突き止めた︵ただしこの実験は当時評価されなかった︶。
●1930年 アメリカのジョン・ノースロップがペプシン、トリプシン、キモトリプシンをタンパク質の結晶として抽出した。
●1931年 ドイツのオットー・ワールブルクが、呼吸酵素の特性および作用機構の発見によってノーベル生理学・医学賞を受賞。
●1913年 ミカエリス、メンテンらがブラウンとルシャトリエの結果を受けて﹁ミカエリス・メンテン式﹂を発表。
●1925年 G・E・ブリッグスとJ・B・S・ホールデンがミカエリス・メンテン式を発展させた﹁ブリッグス・ホールデンの速度論﹂を発表。
●1926年 アメリカのジェームズ・サムナーがナタ豆から﹁ウレアーゼ﹂と呼ばれる酵素を結晶化して、酵素の本体がタンパク質であることを突き止めた︵ただしこの実験は当時評価されなかった︶。
●1930年 アメリカのジョン・ノースロップがペプシン、トリプシン、キモトリプシンをタンパク質の結晶として抽出した。
●1931年 ドイツのオットー・ワールブルクが、呼吸酵素の特性および作用機構の発見によってノーベル生理学・医学賞を受賞。 ●1945年 アメリカのジョージ・ウェルズ・ビードルとエドワード・ローリー・タータムは1つの遺伝子が1つの酵素に対応することを発表した︵一遺伝子一酵素説︶。
●1946年 サムナーとノースロップは酵素の本体がタンパク質であることを証明し、ノーベル化学賞を受賞した。
●1945年 アメリカのジョージ・ウェルズ・ビードルとエドワード・ローリー・タータムは1つの遺伝子が1つの酵素に対応することを発表した︵一遺伝子一酵素説︶。
●1946年 サムナーとノースロップは酵素の本体がタンパク質であることを証明し、ノーベル化学賞を受賞した。 ●1955年 サンガーらはインスリンの一次構造を決定した。
●1955年 スウェーデンのヒューゴ・テオレルが、酸化酵素の研究によってノーベル生理学・医学賞を受賞。
●1955年 サンガーらはインスリンの一次構造を決定した。
●1955年 スウェーデンのヒューゴ・テオレルが、酸化酵素の研究によってノーベル生理学・医学賞を受賞。 ●1960年 アメリカのウィリアム・スタインとスタンフォード・ムーアによって、リボヌクレアーゼのアミノ酸配列が決定された。
●1962年 ジョン・ケンドリューとマックス・ペルーツが、球状タンパク質の構造研究によってノーベル化学賞を受賞。
●1960年 アメリカのウィリアム・スタインとスタンフォード・ムーアによって、リボヌクレアーゼのアミノ酸配列が決定された。
●1962年 ジョン・ケンドリューとマックス・ペルーツが、球状タンパク質の構造研究によってノーベル化学賞を受賞。 ●1965年 イギリスのデビッド・フィリップスはリゾチームと基質の複合体の立体構造を明らかにした︵酵素として立体構造が決定されたのはこれが初めて︶。
●1965年 フランスのフランソワ・ジャコブ、アンドレ・ルウォフ、ジャック・モノーが、酵素およびウイルスの合成の遺伝的調節に関する研究によってノーベル生理学・医学賞を受賞。
●1965年 イギリスのデビッド・フィリップスはリゾチームと基質の複合体の立体構造を明らかにした︵酵素として立体構造が決定されたのはこれが初めて︶。
●1965年 フランスのフランソワ・ジャコブ、アンドレ・ルウォフ、ジャック・モノーが、酵素およびウイルスの合成の遺伝的調節に関する研究によってノーベル生理学・医学賞を受賞。 ●1965年 高崎義幸らが、グルコースイソメラーゼを用いて異性化糖の製造法を発明。
●1968年 H.O.Smith, K.W.ウィルコックスらがDNAの制限酵素を発見した。
●1968年アメリカのジョー・マッコード、アーウィン・フリドビッチがフリーラジカルを排除する酵素、スーパーオキシドジスムターゼ︵SOD︶を発見。
●1969年 アメリカのロバート・メリフィールドが、ペプチド固相合成法を用いて、化学的にリポヌクレアーゼを合成した。
●1972年 スタインとムーアは酵素の一次構造決定によってノーベル化学賞を受賞。
●1965年 高崎義幸らが、グルコースイソメラーゼを用いて異性化糖の製造法を発明。
●1968年 H.O.Smith, K.W.ウィルコックスらがDNAの制限酵素を発見した。
●1968年アメリカのジョー・マッコード、アーウィン・フリドビッチがフリーラジカルを排除する酵素、スーパーオキシドジスムターゼ︵SOD︶を発見。
●1969年 アメリカのロバート・メリフィールドが、ペプチド固相合成法を用いて、化学的にリポヌクレアーゼを合成した。
●1972年 スタインとムーアは酵素の一次構造決定によってノーベル化学賞を受賞。 ●1975年 オーストラリアのジョン・コーンフォースが、酵素による触媒反応の立体化学的研究によってノーベル化学賞を受賞。
●1975年 オーストラリアのジョン・コーンフォースが、酵素による触媒反応の立体化学的研究によってノーベル化学賞を受賞。 ●1978年、アメリカのダニエル・ネーサンズ、ハミルトン・スミス、スイスのヴェルナー・アーバーが制限酵素の発見と分子遺伝学への応用によってノーベル生理学・医学賞を受賞。
●1978年、アメリカのダニエル・ネーサンズ、ハミルトン・スミス、スイスのヴェルナー・アーバーが制限酵素の発見と分子遺伝学への応用によってノーベル生理学・医学賞を受賞。 ●1986年 アメリカのトーマス・チェックらによって触媒作用を有するRNAである﹁リボザイム﹂が発見された。これによって、触媒作用はタンパク質に依らないという概念ができた。さらに生命の起源はRNAから始まったとする﹁RNAワールド仮説﹂の元になっている。
●1986年 アメリカのトラモンタノらは抗体酵素︵abzyme︶を発見した。
●1989年 チェックらはリボザイムの発見によってノーベル化学賞を受賞した。
●1986年 アメリカのトーマス・チェックらによって触媒作用を有するRNAである﹁リボザイム﹂が発見された。これによって、触媒作用はタンパク質に依らないという概念ができた。さらに生命の起源はRNAから始まったとする﹁RNAワールド仮説﹂の元になっている。
●1986年 アメリカのトラモンタノらは抗体酵素︵abzyme︶を発見した。
●1989年 チェックらはリボザイムの発見によってノーベル化学賞を受賞した。 ●1992年 スイスのエドモンド・フィッシャー、アメリカのエドヴィン・クレープスが生体制御機構としての可逆的タンパク質リン酸化の発見によって︵タンパク質キナーゼ︶ ノーベル生理学・医学賞を受賞。
●1992年 スイスのエドモンド・フィッシャー、アメリカのエドヴィン・クレープスが生体制御機構としての可逆的タンパク質リン酸化の発見によって︵タンパク質キナーゼ︶ ノーベル生理学・医学賞を受賞。 ●1997年 アメリカのポール・ボイヤー、イギリスのジョン・E・ウォーカーが、アデノシン三リン酸︵ATP︶の合成の基礎となる酵素機構の解明によって︵ATPシンターゼ︶、デンマークのイェンス・スコウがイオン輸送酵素、Na+、K+-ATPアーゼの最初の発見によってノーベル化学賞を受賞。
●1997年 アメリカのポール・ボイヤー、イギリスのジョン・E・ウォーカーが、アデノシン三リン酸︵ATP︶の合成の基礎となる酵素機構の解明によって︵ATPシンターゼ︶、デンマークのイェンス・スコウがイオン輸送酵素、Na+、K+-ATPアーゼの最初の発見によってノーベル化学賞を受賞。 ●21世紀
●2009年 アメリカのエリザベス・H・ブラックバーン、キャロル・W・グライダー、ジャック・W・ショスタクがテロメアとテロメラーゼ酵素の仕組みの発見によってノーベル生理学・医学賞を受賞。
●21世紀
●2009年 アメリカのエリザベス・H・ブラックバーン、キャロル・W・グライダー、ジャック・W・ショスタクがテロメアとテロメラーゼ酵素の仕組みの発見によってノーベル生理学・医学賞を受賞。 ●2018年 アメリカのフランシス・アーノルドが指向性進化により人工的に酵素を合成する手法を開発し、2018年にノーベル化学賞を受賞した。
●2018年 アメリカのフランシス・アーノルドが指向性進化により人工的に酵素を合成する手法を開発し、2018年にノーベル化学賞を受賞した。
脚注[編集]
注釈[編集]
出典[編集]
(一)^ Murphy JM, Farhan H, Eyers PA (2017). “Bio-Zombie: the rise of pseudoenzymes in biology”. Biochem Soc Trans 45 (2): 537–544. doi:10.1042/bst20160400. PMID 28408493.
(二)^ Murphy JM, et al. (2014). “A robust methodology to subclassify pseudokinases based on their nucleotide-binding properties”. Biochemical Journal 457 (2): 323–334. doi:10.1042/BJ20131174. PMC 5679212. PMID 24107129.
(三)^ ab北川裕久、田島秀浩 、中川原寿俊ら﹁膵頭部癌術後の消化吸収障害に対する高力価・腸溶性膵消化酵素剤投与の有用性についての検討﹂﹃膵臓﹄第28巻第2号、2013年4月25日、178-184頁、doi:10.2958/suizo.28.178、NAID 10031178027。
(四)^ ab伊藤鉄英、安田幹彦、河辺顕ら﹁慢性膵炎の栄養療法﹂﹃日本消化器病學會雜誌﹄第104巻第12号、2007年12月5日、1722-1727頁、doi:10.11405/nisshoshi.104.1722。
(五)^ Raja, MMM; Raja, A; Imran, MM; Santha, AMI; Devasena, K (2011). “Enzymes Application in Diagnostic Prospects”. Biotechnology 10 (1): 51-59. doi:10.3923/biotech.2011.51.59.
(六)^ Payen, A; Persoz, JF (1833). “Mémoire sur la diastase, les principaux produits de ses réactions et leurs applications aux arts industriels” (French trans-title=Memoir on diastase, the principal products of its reactions, and their applications to the industrial arts). Annales de chimie et de physique. 2nd 53: 73-92.
(七)^ Theodor Schwann. Encyclopædia Britannica. 2007. Encyclopædia Britannica Online.
(八)^ Harper, D (2001). "enzyme". Online Etymology Dictionary.
(九)^ Kühne W (1876). “Über das Verhalten verschiedener organisirter und sog. ungeformter Fermente [On the behavior of various organized and so-called unformed ferments]” (German). Verhandlungen des naturhistorisch-medicinischen Vereins zu Heidelberg. new series 1 (3): 190-193.
(十)^ 徳重正信、﹁酵素﹂﹃世界大百科事典﹄(CD-ROM版、第2版)、日立デジタル平凡社、1998年。
(11)^ Fischer E (1894). “Einfluss der Configuration auf die Wirkung der Enzyme”. Ber Dt Chem Ges 27: 2985-93.
(12)^ 1946 Nobel prize for Chemistry laureates at http://nobelprize.org
(13)^ “The Nobel Prize in Chemistry 1946”. The Nobel Prize. NobelPrize.org. 2018年11月4日閲覧。
(14)^ 1989 Nobel prize for Chemistrylaureates at http://nobelprize.org
(15)^ Eisenmesser EZ, Bosco DA, Akke M, Kern D (2002). “Enzyme dynamics during catalysis”. Science 295: 1520-3. PMID 11859194.
(16)^ Agarwal PK (2005). Role of protein dynamics in reaction rate enhancement by enzymes.
journal=J Am Chem Soc. 127. pp. 15248-56. PMID 16248667.
(17)^ Eisenmesser EZ, Millet O, Labeikovsky W, Korzhnev DM, Wolf-Watz M, Bosco DA, Skalicky JJ, Kay LE, Kern D (2005). “Intrinsic dynamics of an enzyme underlies catalysis”. Nature 438: 117-21. PMID 16267559.
(18)^ Åqvist, J., Kazemi, M., Isaksen, G. V., Brandsdal, B. O. (2017). “Entropy and Enzyme Catalysis”. Acc. Chem. Res. 50 (2): 199–207. doi:10.1021/acs.accounts.6b00321.
(19)^ Koshland Jr., D. E. (1958). “Application of a Theory of Enzyme Specificity to Protein Synthesis”. Proc. Natl. Acad. Sci. U.S.A. 44 (2): 98-104. doi:10.1073/pnas.44.2.98.
(20)^ 吉岡 政七, 遠藤 克己﹃新生化学ガイドブック﹄南江堂、1969年、82-119ページ。
(21)^ abcd一島英治﹃酵素の化学﹄朝倉書店、1995年。ISBN 4-254-14555-1
(22)^ Sang-Hwan Oh, Ganther HE, Hoekstra WG (1974). “Selenium as a Component of Glutathione Peroxidase Isolated from Ovine Erythrocytest”. Biochemistry 13: 1825-9. [1]
(23)^ abcdefghijklmnopqrstu"Molecule of the Month" RCSB PDB
(24)^ 長倉三郎他編﹁補欠分子族﹂﹃理化学辞典﹄5版、岩波書店、1998年。長倉三郎他編﹁補酵素﹂﹃理化学辞典﹄5版、岩波書店、1998年。
(25)^ ﹃レーニンジャーの新生化学[上]﹄第4版、廣川書店、監修/山科郁男 編集/中山和久
(26)^ JIS K 3600:2000︵日本産業標準調査会、経済産業省︶
(27)^ 吉岡 政七, 遠藤 克己﹃新生化学ガイドブック﹄南江堂、1969年、89ページ。
(28)^ 長倉三郎他編﹁代謝調節﹂ ﹃理化学辞典﹄5版、岩波書店、1998年。
(29)^ ab今井誠一﹃味噌﹄農山漁村文化協会、2002年。27-29頁。
(30)^ Roxas M (2008-12). “The role of enzyme supplementation in digestive disorders” (pdf). Altern Med Rev 13 (4): 307–14. PMID 19152478.
(31)^ タカヂアスターゼ 日本薬学会
(32)^ “消化酵素製剤解説 処方薬辞典”. 日経メディカル. 2018年7月26日閲覧。
(33)^ Leite AP, de Oliveira BG, Soares MF, Barrocas DL (2012-9). “Use and effectiveness of papain in the wound healing process: a systematic review”. Rev Gaucha Enferm 33 (3): 198–207. doi:10.1590/s1983-14472012000300026. PMID 23405827.
(34)^ “Risk Assessments”. HERA Human and Environmental Risk Assessment on ingredients of household cleaning products. HERA. 2018年11月4日閲覧。
(35)^ 高機能バイオセンサー事業部会編﹃高機能バイオセンサー﹄化学工業日報社、2003年。ISBN 4-87326-429-4
(36)^ T.A. Brown著、村松正實監訳﹃ゲノム 新しい生命情報システムへのアプローチ﹄メディカル・サイエンス・インターナショナル、2000年。ISBN 4-89592-237-5
(37)^ Nitta I, Ueda T, Watanabe K (1998). “Possivble involvement of Escherichia coli 23S ribosomal RNA in peptide bond formation”. RNA 4: 257-67.
(38)^ Nitta I, Kamada Y, Noda H, Ueda T, Watanabe K (1998). “Reconstitution of peptide bond formation with Escherichia coli 23S ribosomal RNA domains”. Science 281: 666-9. PMID 9685252.
(39)^ Scott WG, Klug A (1996). “Ribozymes: structure and mechanism in RNA catalysis”. Trends Biochem Sci 21: 351-5.
(40)^ Szathmary E, Smith JM (1993). “The evolution of chromosomes. II. Molecular mechanisms”. J Theoret Biol 164: 447-54.
(41)^ Csermely P (1997). “Proteins, RNAs and chaperones in enzyme evolution: a folding perspective”. Trends Biochem Sci 22: 147-9.
(42)^ Giovanna Ghirlanda, "Old enzymes, new tricks", Nature 453, 164-166 (2008). doi:10.1038/453164a
関連項目[編集]
●EC番号
●消化酵素
●酵素反応
●リガーゼ
●異性化糖
●酵素反応速度論
●ローフード︵生食︶
外部リンク[編集]
●﹃酵素﹄ - コトバンク ●谷川実﹁酵素反応の基礎 —名前はよく聞くが,よくわからない﹁酵素﹂を知るために—﹂﹃化学と教育﹄第66巻第12号、日本化学会、2018年、584-587頁、doi:10.20665/kakyoshi.66.12_584。
